Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

=> %mH2O = 100% - 37,03% = 62,97%
=> mH2O = \(\dfrac{18a}{23.2+12+16.3+18a}.100\%=62.97\%\)
=> x = 10
=> CTHH: Na2CO3 . 10H2O

3.
- Ta có: m dd CaCl2 = 43,8 + 156,2 = 200 (g)
Mà: C%CaCl2 = 11,1%
\(\Rightarrow\dfrac{m_{CaCl_2}}{m_{ddCaCl_2}}=0,111\) \(\Rightarrow m_{CaCl_2}=22,2\left(g\right)\) \(\Rightarrow n_{CaCl_2}=\dfrac{22,2}{111}=0,2\left(mol\right)\)
Có: \(n_{CaCl_2}=n_{CaCl_2.xH_2O}=\dfrac{43,8}{111+18x}=0,2\left(mol\right)\)
⇒ x = 6
Vậy: CTPT cần tìm là CaCl2.6H2O
- Ta có: \(n_{Na_2CO_3.xH_2O}=n_{Na_2CO_3}=0,1.0,1=0,01\left(mol\right)\)
\(\Rightarrow\dfrac{2,86}{106+18x}=0,01\)
⇒ x = 10
Vậy: CTPT cần tìm là Na2CO3.10H2O.

\(M_{Na2CO3.10H2O}=23.2+12+16.3+10\left(1.2+16\right)=286\left(\frac{g}{mol}\right)\)\(M_{Na2CO3}=23.2+12+16.3=106\left(\frac{g}{mol}\right)\)
Cứ 286g Na2CO3.10H2O chứa 106g Na2CO3
Cứ 143g Na2CO3.10H2O chứa x g Na2CO3
\(\Rightarrow x=143.\frac{106}{286}=53\left(g\right)\)
Ta có:
Hoà tan hết 53g Na2CO3 trong 160g nước ở 18oC thì được dd bão hoà
Hoà tan hết y g Na2CO3 trong 100g nước ở 18oC thì được dd bão hoà
Vậy độ tan của Na2CO3 trong nước ở 18oC là:
\(y=\frac{53.100}{160}=33,125\left(g\right)\)

Ta có: MNa2CO3.10H2O = 23.2+12+16.3+10.(1.2+16)=286 (g/mol)
MNa2CO3 = 23.2+12+16.3 = 106 (g/mol)
Cứ 286g Na2CO3.10H2O chứa 106g Na2CO3
=> Cứ 143g Na2CO3.10H2O chứa x g Na2CO3
=> x = \(\frac{143.106}{286}=53\left(g\right)\)
Ta có: Hoà tan hết 53g Na2CO3 trong 160g nước ở 18oC thì được dd bão hoà
=> Hoà tan hết y g Na2CO3 trong 100g nước ở 18oC thì được dd bão hoà
=> Độ tan của Na2CO3 trong nước ở 18oC là:
y = \(\frac{53.100}{160}=33,125\left(g\right)\)

Ở nhiệt độ 18oC 250g nước hòa tan 53g Na2CO3 để tạo dung dịch bão hòa. Vậy ở nhiệt độ 18oC, 100g nước hòa tan Sg Na2CO3 tạo dung dịch bão hòa.
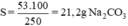
Theo định nghĩa về độ tan, ta có độ tan của Na2CO3 ở 18oC là 21,2g.

Bài 2
MNa2CO3.xH2O = 106+18x
Vì % MNa2CO3 = 37,07% =106 (g/mol)
=> \(\dfrac{106}{106+18x}=37,07\%\)
<=> 106=39,2942+6,6726x
<=> x \(\approx10\)
Vậy x=10
Bài 1 :
PTHH:
\(A+O_{2\left(dư\right)}-->H_2SO_4.n_{SO_3}\)
Vì hỗn hợp A gồm H2, H2S và SO2 có tỷ lệ mol 1:2:3 .
Gỉa sử số mol các chất đó là \(x;2x;3x\)
\(=>n_H=6x;n_S=5x\)
Ta có, theo công thức Oleum :
\(n_H:n_S=2:\left(x+1\right)=6x:5x\)
\(=>x=\dfrac{2}{3}\)
Vậy Y là \(3H_2SO_4.2SO_3\)
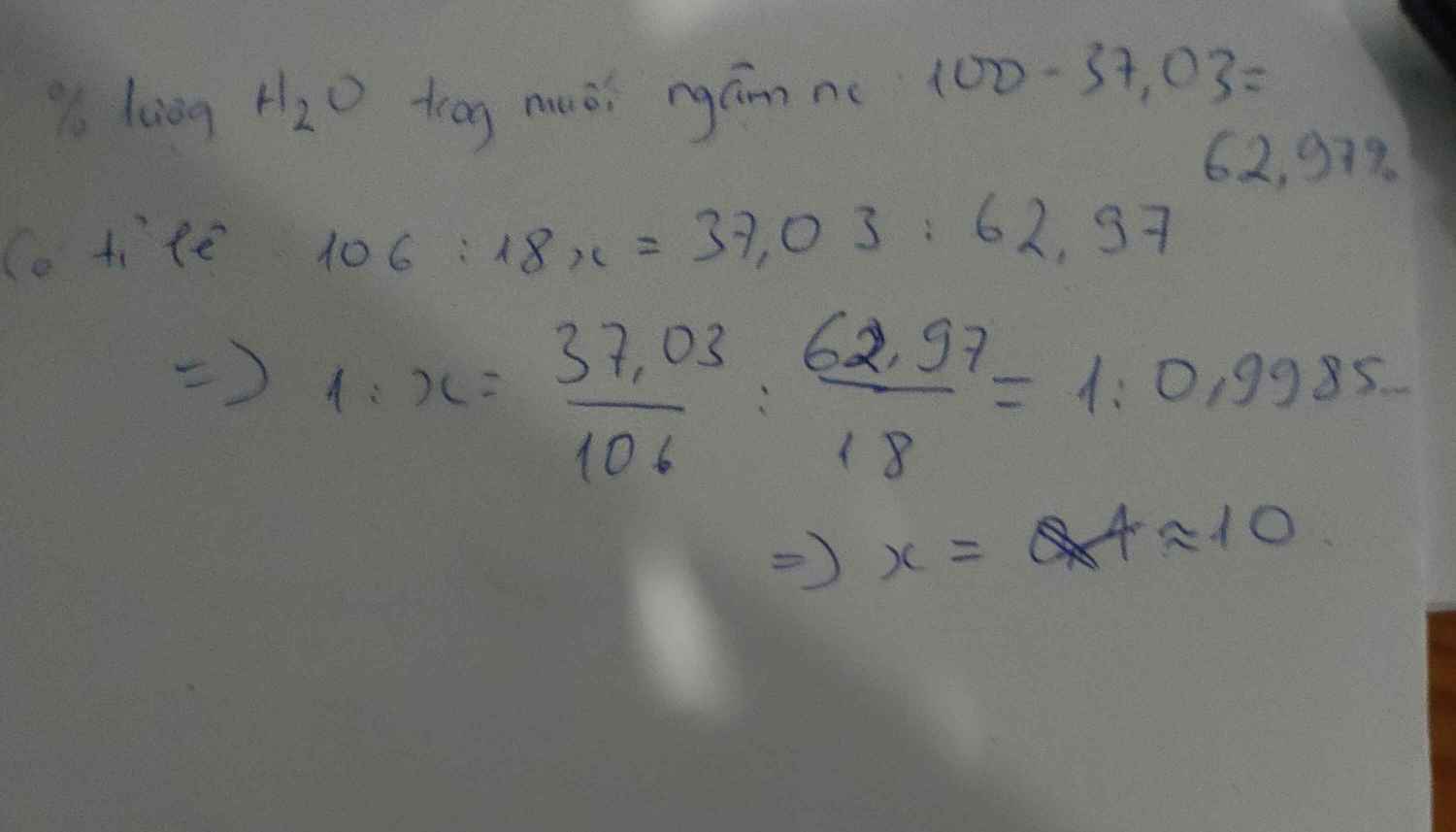
=> %mH2O = 100% - 37,07% = 62,93%
=> mH2O = \(\frac{18x}{23.2+12+16.3+18x}.100\%=62,93\%\)
=> x = 10
=> CTHH: Na2CO3 . 10H2O
Sao ra x= 10 ạ