Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
$Cu + 2H_2SO_4 \to CuSO_4 + SO_2 + H_2O$
$2Fe + 6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O$
b) n Cu =a (mol) ; n Fe = b(mol)
=> 64a + 56b = 12(1)
n SO2 = a + 1,5b = 5,6/22,4 = 0,25(2)
(1)(2) suy ra a = b = 0,1
%m Cu = 0,1.64/12 .100% = 53,33%
%m Fe = 100% -53,33% = 46,67%
c)
n CuSO4 = a = 0,1(mol)
n Fe2(SO4)3 = 0,5a = 0,05(mol)
m muối = 0,1.160 + 0,05.400 = 36(gam)
d) n H2SO4 = 2n SO2 = 0,5(mol)
V H2SO4 = 0,5/2 = 0,25(lít)

Đáp án D.
Gọi nCu = y, nFe = x mol

Áp dụng định luật bảo toàn e ta có: 3x+2y = 0,7 (1)
Khối lượng hai kim loại = 1,84 g: 56x+64y = 184 (2).
Giải 1,2 ta có: x = 0,1, y = 0,2 (mol)
% m F e = 0 , 1 . 56 18 , 4 . 100 % = 30 , 43 %

Đáp án D
Trong X, chỉ có Fe tác dụng với dung dịch H 2 SO 4 loãng theo sơ đồ sau:

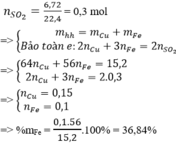
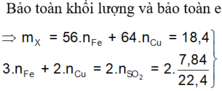
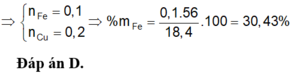
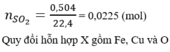
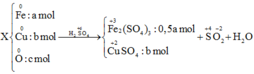
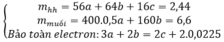
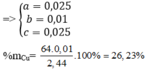

\(n_{KMnO_4}=0,1\left(mol\right)\)
\(PTHH:2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
\(\Rightarrow n_{O_2}=\dfrac{0,1}{2}=0,05\left(mol\right)\)
Đặt \(\left\{{}\begin{matrix}n_{Cu}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\)
Bảo toàn e:\(\Rightarrow2a+3b=0,5\)
Mặt khác: \(64a+56b=13,6-0,05.32=12\)
\(\Rightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\)
\(\Rightarrow\%m_{Fe}=\dfrac{0,1.56}{12}.100\%=46,67\left(\%\right)\)
Tại sao lại có 2a+3b=0,5 ạ ?
Qúa trình nhường e của Fe diễn ra ntn ạ ?