Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Điện phân trong 3378 giây tương đương với số e trao đổi là 0,07 mol
Do trao đổi 0,07 mol e chỉ thu được thêm 0,025 mol Cu, chứng tỏ Cu hết
Lúc này ở catot thu thêm 0,025 mol Cu và 0,01 mol H2
Vậy lúc này ở anot thu được thêm 0,025 mol khí
Do số mol khí trao đổi 0,07 nên chứng tỏ đã có tạo ra O2.
Vậy ở anot thu được Cl2 và O2 với số mol lần lượt là 0,015 và 0,01 mol.
Mặt khác do lúc t giây chỉ thu được Cu ở catot và Cl2 ở anot nên a=b.
Vậy t giây thì n e = 2 a nên 2t giây thì n e = 4 a
Lúc 2t giây ở anot thu được a+0,025 mol Cu và a-0,025 mol H2.
Ở catot thu được a+0,015 mol Cl2 và O2 0,5a-0,0075 mol
Tổng số mol khí thu được là: a-0,025+a+0,015+0,5a-0,0075=2,0625a
Giải được a= 0,04
Vậy số mol CuSO4 là 0,065 mol và KCl là 0,11 mol
=> m=18,595 gam

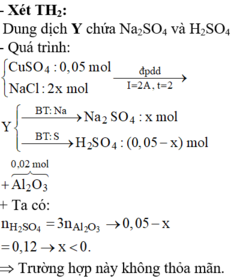
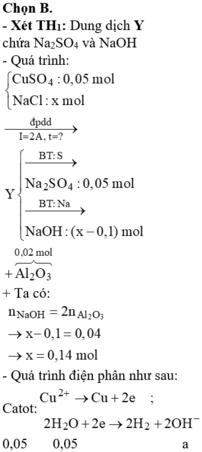
Đáp án B.
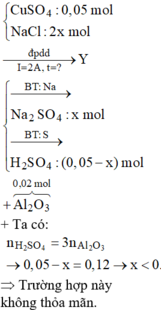
« Nhận xét: dung dịch X hòa tan 0,02 mol Al2O3 thì có 2 khả năng: X chứa 0,04 mol NaOH hoặc 0,06 mol H2SO4. Dựa vào câu: khí thu được ở hai điện cực → xét trường hợp 0,04 mol NaOH trước (vì có NaOH ứng với ở catot thoát ra khí H2; nếu trường hợp này không đúng, sẽ giải trường hợp còn lại).
Thật vậy, X chứa 0,04 mol NaOH + 0,05 mol Na2SO4 → có 0,14 mol NaCl.
→ Đọc dung dịch ra lần lượt là 0,05 mol CuCl2 + 0,04 mol HCl + ? mol H2O.
? mol H2O sinh ? mol H2 và ½ ? mol O2 mà tổng mol khí 2 cực là 0,105 mol → ? = 0,01 mol.
Theo đó, tổng mol electron trao đổi = 0 , 05 × 2 + 0 , 04 + 0 , 01 × 2 = 0 , 16 mol
→ t = 96500 × 0 , 16 : 2 = 7720 s.

Đáp án A
Gọi số mol e lúc t giây là x.
Túc t giây thu được a mol khí ở 2 điện cực và b mol Cu.
Lúc t+2895s thì số mol e là x+0,06 mol thì thu được a+0,03 mol khí và b+0,02 mol Cu.
Ta có: 0,02. 2 < 0,06
chứng tỏ lúc này Cu2+ hết ở catot thu được thêm 0,02 mol Cu và 0,01 mol H2.
Vậy ở anot thu được 0,02 mol khí do vậy khí này gồm cả Cl2 và O2, giải được số mol Cl2 và O2 đều là 0,01 mol.
Vậy lúc t giây thu được số mol Cu là 0,5x=b và khí chỉ là Cl20,5x=a.
Lúc 2t giây thu được 2,125a mol khí và a+0,02 mol Cu.
Số mol e lúc này là 2x.
Ở catot thu được số mol H2 là 2 x - 0 , 5 x + 0 , 02 . 2 2 = 0 , 5 x - 0 , 02 mol
Ở anot thu được Cl2 là 0,5x +0,01 mol và O2 2 x - 0 , 5 x + 0 , 01 . 2 4 = 0 , 25 x - 0 , 005
→ 0,5x - 0,02 +0,5x + 0,01 + 0,25x - 0,005 = 2,125a = 2,125.0,5x
Giải được: x=0,08.
Vậy dung dịch ban đầu chứa CuSO4 0,06 mol và NaCl 0,1 mol.
Dừng điện phân ở thời điểm 5404 giây tức số mol e là 0,112 mol.
Ở catot thu được Cu: 0,056 mol.
Ở anot thu được Cl2 0,05 mol và O2 0,003 mol.
Do vậy dung dịch sau điện phân chứa Cu2+ dư 0,004 mol, H+ 0,012 mol, Na+ và SO42-.
Khi cho thanh Fe vào thì khối lượng thanh Fe giảm đi 0,006.56 - 0,004(64 - 56) = 0,304 gam

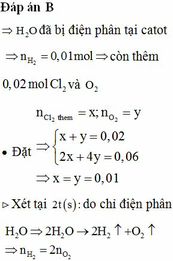



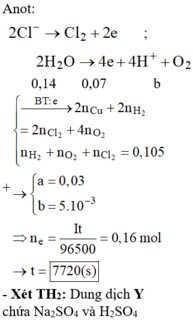
Chọn đáp án C