
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

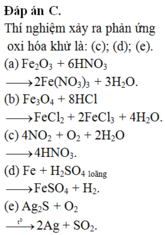

Đáp án C
Phương pháp: Phản ứng có sự thay đổi số oxi hóa là phản ứng oxi hóa khử.
(a) S. Do Fe có số oxi hóa cao nhất là +3
(b) S. Do bản chất Fe3O4 là FeO.Fe2O3 mà sau phản ứng vẫn tạo FeCl2 và FeCl3
(c) Đ
(d) Đ
(e) Đ. Ag2S + O2 → 2Ag + SO2 (nhiệt độ)
Các phản ứng oxi hóa khử là: (c), (d), (e)

Chọn A.
Các phản ứng có sự thay đổi số oxi hoá là (a), (c), (d), (e).

Chọn D.
(1) Cu + Fe2(SO4)3 ® CuSO4 + 2FeSO4
(2) 2CO2 + Ca(OH)2 ® Ca(HCO3)2
(3) 4NO2 + O2 + 2H2O ® 4HNO3
(4) MnO2 + 4HCl → t ∘ MnCl2 + Cl2 + 2H2O
(5) 2FeO + 4H2SO4 ® Fe2(SO4)3 + SO2 + 4H2O
(6) Fe3O4 + 8HCl ® FeCl2 + 2FeCl3 + 4H2O

Phản ứng oxi hóa khử là phản ứng có sự thay đổi số oxi hóa của một số nguyên tố.
Thí nghiệm (1): SO2 tác dụng với dung dịch KMnO4
SO2 tác dụng với dung dịch KMNO4 là phản ứng oxi hóa khử vì KMnO4 là chất oxi hóa mạnh, ![]() bị oxi hóa đến mức oxi hóa cao nhất là
bị oxi hóa đến mức oxi hóa cao nhất là ![]() :
:
![]()
![]()
Ø Thí nghiệm (2): SO2 tác dụng với dung dịch H2S
Phương trình hóa học: ![]()
=> Phản ứng oxi hóa khử.
Đặc điểm nhận ra nhanh phản ứng giữa SO2 và H2S là phản ứng oxi hóa khử vì có đơn chất S được sinh ra.
Ø Thí nghiệm (3): Sục hỗn hợp khí NO2 và O2 vào nước.
Đặc điểm nhận ra nhanh nhất phản ứng giữa NO2, O2 và H2O là phản ứng oxi hóa khử vì có sự thanh gia của đơn chất O2: ![]()
Ø Thí nghiệm (4): MnO2 là chất oxi hóa mạnh, do đó MnO2 sẽ oxi hóa ![]() thành
thành ![]()
![]()
=> Thí nghiệm (4) xảy ra phản ứng oxi hóa khử
Thí nghiệm (5): Mặc dù H2SO4 đặc là chất oxi hóa mạnh nhưng khi tác dụng với chất không có tính khử (số oxi hóa của nguyên tố cao nhất) thì cũng không xảy ra phản ứng oxi hóa khử. Thí dụ:
![]()
=> Thí nghiệm (5) không xảy ra phản ứng oxi hóa khử
Thí nghiệm (6): Phương trình hóa học: ![]()
=> Thí nghiệm (6) không xảy ra phản ứng oxi hóa khử.
Các thí nghiệm xảy ra phản ứng hóa khử là: (1),(2),(3),(4). Đáp án D

Đáp án D
Phản ứng oxi hóa khử là phản ứng có sự thay đổi số oxi hóa của một số nguyên tố.
-Thí nghiệm (1): SO2 tác dụng với dung dịch KMnO4
SO2 tác dụng với dung dịch KMNO4 là phản ứng oxi hóa khử vì KMnO4 là chất oxi hóa mạnh, SO 2 4 + bị oxi hóa đến mức oxi hóa cao nhất là S 6 + :
5 SO 2 4 + + 2 KMnO 4 7 + + 2 H 2 O → K 2 S 6 + O 4 + 2 Mn 2 + S 6 + O 4 + 2 H 2 S 6 + O 4
-Thí nghiệm (2): SO2 tác dụng với dung dịch H2S
Phương trình hóa học: S + 4 O 2 + 2 H 2 S - 2 → 3 S 0 ↓ + 2 H 2 S => Phản ứng oxi hóa khử.
Đặc điểm nhận ra nhanh phản ứng giữa SO2 và H2S là phản ứng oxi hóa khử vì có đơn chất S được sinh ra.
-Thí nghiệm (3): Sục hỗn hợp khí NO2 và O2 vào nước.
Đặc điểm nhận ra nhanh nhất phản ứng giữa NO2, O2 và H2O là phản ứng oxi hóa khử vì có sự thanh gia của đơn chất O2: 4 N + 4 O 2 + O 2 0 + H 2 O → 4 H N + 5 O - 2 3
-Thí nghiệm (4): MnO2 là chất oxi hóa mạnh, do đó MnO2 sẽ oxi hóa thành Cl 0 2
Mn + 4 O 2 + 4 H C l - 1 → t ° M n + 2 C l 2 + C l 0 2 ↑ + 2 H 2 O
Thí nghiệm (4) xảy ra phản ứng oxi hóa khử
-Thí nghiệm (5): Mặc dù H2SO4 đặc là chất oxi hóa mạnh nhưng khi tác dụng với chất không có tính khử (số oxi hóa của nguyên tố cao nhất) thì cũng không xảy ra phản ứng oxi hóa khử. Thí dụ:
Fe + 3 2 O 3 + 3 H 2 S + 6 O 4 ( đ ặ c ) → Fe 2 ( SO 4 ) 3 + 3 H 2 O
Thí nghiệm (5) không xảy ra phản ứng oxi hóa khử
-Thí nghiệm (6): Phương trình hóa học: Si + 4 O 2 - 2 + 4 H + 1 F + 1 → S i + 4 F - 1 4 + 2 H 2 O
Thí nghiệm (6) không xảy ra phản ứng oxi hóa khử.
Các thí nghiệm xảy ra phản ứng hóa khử là: (1),(2),(3),(4).