
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Quá trình oxi hóa: \(\overset{+3}{Fe_2}+6e\rightarrow\overset{0}{2Fe}\)
0,25 -->1,5 (mol)
\(\Rightarrow\) Chọn D

thí nghiệm chi cái giờ bắt học sinh tính mắc mệt:( ai giúp em zới
PTHH:
Fe3O4 + 4CO -> (t°) 3Fe + 4CO2
0,2 ---> 0,8 ---> 0,6 ---> 0,8
Fe2O3 + 3H2 -> (t°) 2Fe + 3H2O
0,2 ---> 0,6 ---> 0,4 ---> 0,6
VCO = 0,8 . 22,4 = 17,92 (l)
VH2 = 0,6 . 22,4 = 13,44 (l)
nFe = 0,4 + 0,6 = 1 (mol)
mFe = 1 . 56 = 56 (g)

Fe2O3 + 2Al => Al2O3 + 2Fe
\(\frac{23}{3200}\) \(\frac{23}{1600}\)(mol)
Al0 => Al+3 + 3e
\(\frac{23}{1600}\) \(\frac{69}{1600}\)(mol)

Đáp án C.
Do số mol FeO bằng số mol Fe2O3,
Coi hỗn hợp chỉ có Fe3O4.
![]()
Fe3O4 + 4H2SO4 → Fe2(SO4)3 + FeSO4 + 4H2O
0,01 0,04
V = 0,04/0,5 = 0,08 lít

Bài 1:
Ta có: \(n_{HCl}=0,08.1=0,08\left(mol\right)\)
BTNT H và O, có: \(n_{H_2O}=\dfrac{1}{2}n_{HCl}=0,04\left(mol\right)\)
⇒ nO (trong oxit) = nH2O = 0,04 (mol)
Có: mhh = mFe + mO
⇒ mFe = 2,32 - 0,04.16 = 1,68 (g)
Bài 2:
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
BTNT H, có: \(n_{HCl}=2n_{H_2}=0,4\left(mol\right)\)
\(\Rightarrow V_{ddHCl}=\dfrac{0,4}{0,5}=0,8\left(l\right)\)
Bạn tham khảo nhé!

Quy đổi thành Fe (a mol), O (b mol)
\(H_2+\left[O\right]->H_2O\\ n_O=n_{H_2}=0,05mol\\ m_{O\left(hh\right)}=16.0,05=0,8g\\ n_{Fe\left(hh\right)}=\dfrac{3,04-0,8}{56}=0,04mol\\ BT.electron:2n_{SO_2}+2n_O=3n_{Fe}\\ n_{SO_2}=\dfrac{3.0,04-2.0,05}{2}=0,01mol\\ V=22,4.0,01=2,24L\)

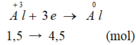
Fe2O3------>2Fe + 6e
0.25------------------>1.5mol
Fe2O3------>3O + 6e
0.25----------------------1.5mol
vậy số mol e cần dùng là 3mol