Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(\left\{{}\begin{matrix}Z+N=63\\2Z-N=24\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}Z=29=P=E\\N=34\end{matrix}\right.\)
\(n_X=\dfrac{15,75}{63}=0,25\left(mol\right)\)
=> \(0,25.6.10^{23}.29.2+0,25.6.10^{23}.34=1,38.10^{25}\) (hạt)
=> Chọn A

3. Khối lượng mol của hợp chất đó là :
2.28 = 56 (g/mol)
mC = \(\frac{56.85,7}{100}\approx48\left(g\right)\)
mH = 56 - 48 = 8 (g)
nC = \(\frac{48}{12}=4\left(mol\right)\)
nH = \(\frac{8}{1}=8\left(mol\right)\)
Vậy công thức hóa học là C4H8.

C
Các tính chất 1, 2, 4, 6, 7 biến đổi tuần hoàn trong một chu kì.

Chọn B
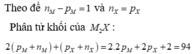
X chiếm 8/47 phần khối lượng => Nguyên tử khối X=16 và M=39
=> Số proton trong X là 8 (oxi), trong M là 19 (kali)
Hợp chất K 2 O có liên kết ion.
\(n_{Al_2\left(SO_4\right)_3}=\dfrac{3,42}{342}=0,01\left(mol\right)\\ \Rightarrow n_{Al}=0,01.2=0,02\left(mol\right)\\ n_S=0,01.3=0,03\left(mol\right)\\ n_O=0,01.4.3=0,12\left(mol\right)\)
Số nguyên tử của từng nguyên tố có trong 3,42 gam Al2(SO4)3:
- Số nguyên tử Al: \(0,02.6,02.10^{23}=0,1204.10^{23}\left(nguyên.tử\right)\)
- Số nguyên tử S: \(0,03.6,02.10^{23}=0,1806.10^{23}\left(nguyên.tử\right)\)
- Số nguyên tử O: \(0,12.6,02.10^{23}=0,7224.10^{23}\left(nguyên.tử\right)\)