Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C. Vì chỉ rõ các ion nào đã tác dụng với nhau làm cho phản ứng xảy ra.

1. 2 N H 4 + + S O 4 2 - + B a 2 + + 2 O H - → B a S O 4 ↓ + 2 N H 3 ↑ + 2 H 2 O
2. Số mol B a S O 4 : 17,475/233 = 0,075(mol)
Theo phản ứng, vì lấy dư dung dịch B a ( O H ) 2 nên S O 4 2 - chuyển hết vào kết tủa B a S O 4 và N H 4 + chuyển thành N H 3 . Do đó :
n S O 4 2 - = n B a S O 4 = 0,075 mol ;
n N H 4 + = 2. n S O 4 2 - = 2. 0,075 = 0,15 (mol).
Nồng độ mol của các ion N H 4 + và S O 4 2 - trong 75 ml dung dịch muối amoni sunfat :
[ N H 4 + ] = 2 (mol/l)
[ S O 4 2 - ] = 1 (mol/l)

\(2NaHCO_3+H_2SO_4\rightarrow Na_2SO_4+2CO_2+2H_2O\)
\(HCO_3^-+H^+\rightarrow CO_2+H_2O\)
\(2NaHCO_3+2KOH\rightarrow Na_2CO_3+K_2CO_3+2H_2O\)
\(HCO_3^-+OH^-\rightarrow CO_3^{2-}+H_2O\)
\(2NaHCO_3+Ba\left(OH\right)_2\rightarrow Na_2CO_3+BaCO_3+2H_2O\)
\(HCO_3^-+Ba^{2+}+OH^-\rightarrow BaCO_3+CO_3^{2-}+H_2O\)

Chọn đáp án A
(1) Trong 3 dung dịch có cùng pH là HCOOH, HCl và H2SO4 thì dung dịch có nồng độ mol lớn nhất là HCOOH. Đúng vì HCOOH điện ly không hoàn toàn.
(2) Phản ứng trao đổi ion không kèm theo sự thay đổi số oxi hóa của nguyên tố. (chuẩn)
(3) Có thể phân biệt trực tiếp 3 dung dịch: KOH, HCl, H2SO4 (loãng) bằng một thuốc thử là BaCO3.(Chuẩn)
(4) Axit, bazơ, muối là các chất điện li.(Chuẩn)
(5) Dung dịch CH3COONa và dung dịch C6H5ONa đều là dung dịch có pH >7.(Chuẩn)
(6) Theo thuyết điện li, SO3 và C6H6 (benzen) là những chất điện li yếu.
(Sai – các chất trên là những chất không điện ly.Vì khi tan trong dung môi nó không phân li thành cac ion.Chú ý khi SO3 tan vào H2O thì chất điện ly là axit H2SO4 chứ không phải SO3)

Chọn D
A sai vì là phản ứng hóa hợp.
B sai vì là phản ứng thế.
C sai vì không thỏa mãn điều kiện xảy ra phản ứng trao đổi.

Chọn D
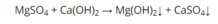
A sai vì là phản ứng hóa hợp.
B sai vì là phản ứng thế.
C sai do không thỏa mãn điều kiện xảy ra phản ứng trao đổi.
Chọn C.
Vì chỉ rõ các ion nào đã tác dụng với nhau làm cho phản ứng xảy ra.