Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

trên phương trình ở trên cái mũi tể bạn thêm đpmn vào là được
điện phân có màng để ngăn ko cho khí thoát ra phản ứng tiếp với sản phẩm vừa tạo thành. vd
+ Điện phân có màng ngăn NaCl:
2NaCl + 2H2O -> 2NaOH + H2↑ + Cl2↑ (1)
+ Điện phân không có màng ngăn, khí Cl2 sẽ phản ứng với NaOH (do không phân màng) tạo NaCl và NaClO (nước Javen) :
2NaCl + 2H2O -> NaCl + NaClO + H2O + H2↑

Hiện tượng thí nghiệm: Ở catot có khí không màu thoát ra, ở anot có khí màu vàng lục thoát ra.
2NaCl + 2H2O → d p m n 2NaOH + Cl2 ↑ + H2 ↑

\(CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O\\ n_{CO_2} = n_{CaCO_3} = \dfrac{150}{100} = 1,5(mol)\\ C_6H_{12}O_6 \xrightarrow{men, t^o} 2CO_2 + 2C_2H_5OH\\ n_{C_6H_{12}O_6} = \dfrac{1}{2}n_{CO_2} = 0,75(mol)\\ \Rightarrow m = \dfrac{0,75.180}{65\%} = 207,7(gam)\\ n_{C_2H_5OH} = n_{CO_2} = 1,5(mol)\\ V_{C_2H_5OH} = \dfrac{1,5.46}{0,8} = 86,25(ml)\\ V_{C_2H_5OH\ 55^o} = \dfrac{86,25.100}{55} = 156,82(ml)\)

TK
a) Phương trình hóa học: Na2CO3 + Ca(OH)2 → CaCO3 + 2NaOH
b) Số mol NaOH điều chế được: nNaOH = 2nNa2CO3 =0,25. 2 = 0,5 mol

Cho quỳ tím ẩm vào các chất khí
+ Quỳ hóa đỏ: HCl
+ Quỳ hóa đỏ sau đó mất màu: Cl2
\(Cl_2+H_2O⇌HCl+HClO\)
+ Không hiện tượng: N2, O2, H2
Cho que đóm vào 3 khí trên
+ Que đóm bùng cháy: O2
+ Que đóm cháy với ngọn lửa màu xanh nhạt : H2
+ Que đóm không có hiện tượng: N2

\(n_{NaCl}=2.2=4\left(mol\right)\)
=> \(n_{NaCl\left(pư\right)}=\dfrac{4.85}{100}=3,4\left(mol\right)\)
PTHH: 2NaCl + 2H2O --> 2NaOH + H2 + Cl2
3,4-------------------->3,4
=> mNaOH = 3,4.40 = 136(g)

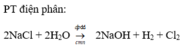
Nếu không có màng ngăn sản phẩm Cl2 và H2 lại tác dụng với nhau tạo khí HCl