Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

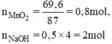
a) Phương trình hóa học của phản ứng:
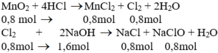
b) Theo pt (1): nCl2 = nMnCl2 = nMnO2 = 0,8 mol
Theo pt (2): nNaCl = nNaClO = nCl2 = 0,8 mol
nNaOH pư = 2. nCl2 = 2. 0,8 = 1,6 mol
⇒ nNaOH dư = 2 - 1,6 = 0,4 mol
Nồng độ mol/l của các chất trong dung dịch sau phản ứng:
CM (NaCl) = CM (NaClO) = CM(MnCl2) = 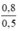 = 1,6 mol/ lit
= 1,6 mol/ lit
CM (NaOH)dư = 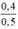 = 0,8 mol/ lit
= 0,8 mol/ lit

3 Cl 2 + 2KOH → KCl + KClO + 3 H 2 O
Trong các phản ứng trên, clo vừa là chất oxi hoá, vừa là chất khử. Đó là các phản ứng tự oxi hoá, tự khử (hay còn gọi là phản ứng tự oxi hoá - khử).

Chọn đáp án A
Chú ý : Vận tốc phản ứng khác dịch chuyển cân bằng.Khi tăng áp thì nồng độ các chất đều tăng dẫn tới vận tốc thuận và nghịch đều tăng.

Chọn B
Ở nhiệt độ t 2 hỗn hợp khí có tỉ khối hơi so với H 2 lớn hơn nhiệt độ t 1 → ở nhiệt độ t 2 có lượng N 2 O 4 lớn hơn ở nhiệt độ t 1 .
Mà t 1 > t 2 → khi giảm nhiệt độ cân bằng chuyển dịch theo chiều thuận (tạo thành N 2 O 4 không màu); khi tăng nhiệt độ cân bằng chuyển dịch theo chiều nghịch (tạo thành N O 2 màu nâu).

nNaOH = 0,5 x 4 = 2 mol
a) Phương trình hóa học của phản ứng :
MnO2 + 4 HCl → MnCl2 + Cl2 +2H2O
0,8 mol 0,8mol 0,8 mol
Cl2 + 2NaOH → NaCl + NaClO + H2O
0,8 mol → 1,6 mol 0,8mol 0,8mol
b) Nồng độ mol/l của các chất trong dung dịch sau phản ứng:
CM(NaCl) = = CM(NaClO) =
= 1,6 mol/l
CM(NaOH)dư = = 0,8 mol/l

Đáp án D