Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1)
Gọi số mol KMnO4, KClO3 là a, b (mol)
=> 158a + 122,5b = 308,2 (1)
PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
a-------------------------------->0,5a
2KClO3 --to--> 2KCl + 3O2
b------------------>1,5b
=> mO2 = (0,5a + 1,5b).32 = 16a + 48b (g)
mD = 308,2 - 16a - 48b(g)
\(m_{Mn}=\dfrac{\left(308,2-16a-48b\right).10,69}{100}=32,94658-1,7104a-5,1312b\left(g\right)\)
=> \(n_{Mn}=\dfrac{32,94658-1,7104a-5,1312b}{55}=0,6-\dfrac{1069}{34375}a-\dfrac{3207}{34375}\left(mol\right)\)
Mà \(n_{Mn}=n_{KMnO_4}=a\left(mol\right)\)
=> \(\dfrac{35444}{34375}a+\dfrac{3207}{34375}b=0,6\) (2)
(1)(2) => a = 0,4 (mol); b = 2 (mol)
=> \(\left\{{}\begin{matrix}\%m_{KMnO_4}=\dfrac{0,4.158}{308,2}.100\%=20,506\%\\\%m_{KClO_3}=\dfrac{2.122,5}{308,2}.100\%=79,494\%\end{matrix}\right.\)
2)
Giả sử nung 100 (g) đá vôi
=> \(m_{CaCO_3\left(bđ\right)}=\dfrac{80.100}{100}=80\left(g\right)\)
\(m_{rắn.sau.pư}=\dfrac{100.73,6}{100}=73,6\left(g\right)\)
=> mCO2 = 100 - 73,6 = 26,4 (g)
\(n_{CO_2}=\dfrac{26,4}{44}=0,6\left(mol\right)\)
PTHH: CaCO3 --to--> CaO + CO2
0,6<----------------0,6
=> mCaCO3(pư) = 0,6.100 = 60 (g)
\(H\%=\dfrac{60}{80}.100\%=75\%\)

Gọi \(n_{KClO_3}=a,n_{KMnO_4}=b\)
\(2KClO_3\underrightarrow{t_o}2KCl+3O_2\)
a \(\dfrac{3}{2}a\)
\(2KMnO_4\underrightarrow{t_o}K_2MnO_4+MnO_2+O_2\)
b \(\dfrac{1}{2}b\)
\(n_{O_2}=\dfrac{49,28}{22,4}=2,2mol\)
Ta có hệ:
\(\left\{{}\begin{matrix}122,5a+158b=47,2\\\dfrac{3}{2}a+\dfrac{1}{2}b=2,2\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}a=\dfrac{1296}{703}\\b=-\dfrac{3974}{3515}\end{matrix}\right.\)
Đề bị lỗi rồi em nhé!!!

\(n_{H_2}=\dfrac{5,6}{22,4}=0,25(mol)\\ a,PTHH:Fe+2HCl\to FeCl_2+H_2\\ 2Al+6HCl\to 2AlCl_3+3H_2\)
\(b,\) Đặt \(n_{Fe}=x(mol);n_{Al}=y(mol)\)
\(\Rightarrow 56x+27y=8,3(1)\)
Theo PTHH: \(x+1,5y=0,25(2)\)
\((1)(2)\Rightarrow x=y=0,1(mol)\\ \Rightarrow \%_{Fe}=\dfrac{0,1.56}{8,3}.100\%=67,47\%\\ \%_{Al}=100\%-67,47\%=32,53\%\)

phân tích 273g hỗn hợp muối KClO3 và KMnO4 ta thu được 49.27l oxi (đktc)
a,Viết phương trình hóa học phản ứng
b, Tính thành phần % khối lượng của các chất có trong hỗn hợp muối
\(a) PTHH:\)
\(2KClO3 -(nhiệt)-> 2KCl + 3O2\) (1)
\(2KMnO4 -(nhiệt)-> K2MnO4 + MnO2 +O2\)(2)
\(b)\)
Đặt a là nKClO3, b là nKMnO4
Ta có: 122,5a 158b
Ta có: \(122,5a + 158b = 273 \) (I)
nO2 thu được = \(\dfrac {49,27} {22,4}\)= \(2,1995 (mol) \)
Theo (1) và (2): \(1,5a + 0,5b = 2,1995\) (II)
Giai hệ (I) và (II), \(\begin{cases} a=1,2 \\ b = 0,8 \end{cases}\)
%mKClO3 = \(\frac{1,2.122,5.100}{273}\) = 53,85%
=> %mKMnO4 = 100% - 53,85% = 46,15%
PTHH: \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\left(1\right)\)
\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\left(2\right)\)
\(n_{O_2}=\dfrac{49,27}{22,4}=\dfrac{4927}{2240}\left(mol\right)\)
Đặt số mol KClO3 là x, số mol KMnO4 là y, ta có hệ:
\(\left\{{}\begin{matrix}122,5x+158y=273\\1,5x+0,5y=\dfrac{4927}{2240}\end{matrix}\right.\)
\(\left\{{}\begin{matrix}x=1,200736639\\y=0,7968972262\end{matrix}\right.\)
\(m_{KClO_3}=1,200736639.122,5=147,0902383\left(g\right)\)
\(m_{KMnO_4}=273-147,0902383=125,9097617\left(g\right)\)
\(\%KClO_3=\dfrac{147,0902383}{273}.100\%=53,88\%\)
\(\%KMnO_4=100\%-53,88\%=46,12\%\)

nO2 = 49,28/22,4 = 2,2 (mol)
PTHH: C + O2 -> (t°) CO2
Mol: 2,2 <--- 2,2
mC = 2,2 . 12 = 26,4 (g)
mthan = 26,4/96% = 27,5 (g)

Gọi x, y lần lượt là số mol của KMnO4 và KClO3.
Theo đề, ta có: 158x + 122,5y = 56,1 (*)
Ta có: \(n_{O_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
PTHH:
\(2KMnO_4\overset{t^o}{--->}K_2MnO_4+MnO_2+O_2\left(1\right)\)
\(2KClO_3\xrightarrow[MnO_2]{t^o}3KCl+3O_2\left(2\right)\)
Theo PT(1): \(n_{O_2}=\dfrac{1}{2}.n_{KMnO_4}=\dfrac{1}{2}x\left(mol\right)\)
Theo PT(2): \(n_{O_2}=\dfrac{3}{2}.n_{KClO_3}=\dfrac{3}{2}y\left(mol\right)\)
\(\Rightarrow\dfrac{1}{2}x+\dfrac{3}{2}y=0,4\) (**)
Từ (*) và (**), ta có HPT:
\(\left\{{}\begin{matrix}158x+122,5y=56,1\\\dfrac{1}{2}x+\dfrac{3}{2}y=0,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,2\end{matrix}\right.\)
\(\Rightarrow m_{KMnO_4}=158.0,2=31,6\left(g\right)\)
\(m_{KClO_3}=0,2.122,5=24,5\left(g\right)\)

Khối lượng oxi thoát ra: m O 2 = 197 + 3 – 152 = 48(g)
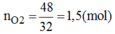
PTHH của phản ứng:
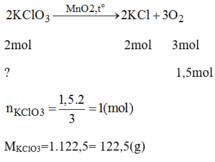
Khối lượng của KCl trong hỗn hợp ban đầu:
m K C l = 197-122,5 = 74,5(g)
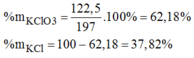

a, PT: \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
b, Gọi: \(\left\{{}\begin{matrix}n_{KClO_3}=x\left(mol\right)\\n_{KMnO_4}=y\left(mol\right)\end{matrix}\right.\) ⇒ 122,5x + 158y = 43,85 (1)
Ta có: \(n_{O_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{3}{2}n_{KClO_3}+\dfrac{1}{2}n_{KMnO_4}=\dfrac{3}{2}x+\dfrac{1}{2}y=0,25\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{KClO_3}=\dfrac{0,1.122,5}{43,85}.100\%\approx27,94\%\\\%m_{KMnO_4}\approx72,06\%\end{matrix}\right.\)