Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án B
(1) S2- < Cl- < Ar < K+ là dãy được sắp xếp theo chiều tăng dần bán kính nguyên tử.
Sai: Vì cùng e mà điện tích to thì bán kính nguyên tử sẽ nhỏ
(2) Có 3 nguyên tố mà nguyên tử của nó ở trạng thái cơ bản có cấu trúc electron ở lớp vỏ ngoài cùng là 4s1. Đúng: (Cu - K - Cr)
(3) Cacbon có hai đồng vị, Oxi có 3 đồng vị. Số phân tử CO2 được tạo ra từ các đồng vị trên là 12.
Sai, có 18 phân tử
(4) Cho các nguyên tố: O, S, Cl, N, Al. Khi ở trạng thái cơ bản: tổng số electron độc thân của chúng là: 11
(5) Các nguyên tố: F, O, S, Cl đều là những nguyên tố p. Đúng
(6) Nguyên tố X tạo được hợp chất khí với hiđro có dạng HX. Vậy X tạo được oxit cao X2O7.
Sai vì HF thì không thể tạo được F2O7

Chọn đáp án A
Có thể dùng đặc điểm cấu hình electron kim loại thường có 1, 2 hoặc 3 electron lớp ngoài cùng nhưng điều này chưa đúng 100% nên tốt nhất là nhớ số proton để tìm chính xác nguyên tố
(1) có Z = 19 là cấu hình của kali Þkim loại
(2) có Z = 15 là cấu hình của photpho Þ phi kim
(3) có Z = 13 là cấu hình của nhôm Þ kim loại
(4) có Z = 7 là cấu hình của nitơ Þ phi kim
(5) có Z = 12 là cấu hình của magie Þ kim loại
(6) có Z = 11 là cấu hình của natri Þ kim loại

Cu(NO3)2 ---> CuO + 2NO2 + 1/2O2
Khối lượng chất rắn sau khi nung giảm = 30,8 - 24,32 = 6,48 g = khối lượng khí thoát ra = 46.2x + 32.1/2x (x là số mol CuO).
Thu được x = 0,06 mol.
a) Tổng số mol khí = 2x + x/2 = 2,5x = 0,15 mol. V = 0,15.22,4 = 3,36 lít.
b) Chất rắn gồm CuO (x mol, 80.0,06 = 4,8 g) và Cu(NO3)2 dư có khối lượng = 30,8 - 188.0,06 = 19,52 g.

Ta có: Kí hiệu thể hiện trạng thái nguyên tử có dạng \(^{2S+1}X_J\) trong đó
- S; là giá trhij momen động lượng spin tổng
- 2S+1: là độ bội; J: là giá trị momen toàn phần chủa toàn nguyên tử;
- X là kí hiệu tương ứng với giá trị của momen động lượng L
Vậy
a)Đối với số hang: \(^2D\) ta có độ bội 2S+1=2 suy ra S= 1/2 và kí hiệu D tương ứng với L=2
J= |L-S| = |2-\(\frac{1}{2}\)|= \(\frac{3}{2}\) hoặc J = |L+S| = |2+\(\frac{1}{2}\)| =\(\frac{5}{2}\)
vậy từ số hạng đã biết là \(^2D\) ta có trạng thái ứng với mức năng lượng có thể có trong phân tử là \(^2D_{\frac{3}{2}}\) và \(^2D_{\frac{5}{2}}\).
b) Đối với số hạng: \(^1G\) tương tự ta có độ bội 2S+1=1 nên S=0 và kí hiệu G tương ứng L=4
J=|L-S| = |4-0| =4 hoặc J= |L+S| = |4+0|= 4
Vậy ta có trạng thái ứng với mức năng lượng của số hạng có thể có trong phân tử là : \(^1G_4\).
c) Đối với số hạng: \(^6S\) tương tự ta có độ bội là 2S+1=6 nên S= \(\frac{5}{2}\) và kí hiệu S ứng với L=0
J=|L+S|= |0+\(\frac{5}{2}\)| = \(\frac{5}{2}\) hoặc J= |L-S|=|0-\(\frac{5}{2}\)|=\(\frac{5}{2}\)
vậy ta có trạng thái ứng với mức năng lượng của số hạng đã biết có thể có trong phân tử là : \(^6S_{\frac{5}{2}}\)
Số hạng nguyên tử có dạng : 2S+1XJ
*/số hạng 2D \(\Rightarrow\) 2S + 1 = 2 \(\Rightarrow\)đội bội : S = \(\frac{1}{2}\) ; mặt khác S = \(\frac{N}{2}\) \(\Rightarrow\)N = 1 vậy số e độc thân = 1
số hạng ứng với X = D \(\Rightarrow\)L = 2 ; J = | L+ S | \(\Rightarrow\)J = |2+ \(\frac{1}{2}\)| = \(\frac{5}{2}\) và J = | 2 - \(\frac{1}{2}\)| = \(\frac{3}{2}\)
nên số hạng 2D ứng với trạng thái 2D\(\frac{3}{2}\) và 2D\(\frac{5}{2}\)
*/số hạng 1G \(\Rightarrow\) 2S + 1 = 1 \(\Rightarrow\)đội bội : S = 0 ; mặt khác S = \(\frac{N}{2}\) \(\Rightarrow\)N = 0 vậy số e độc thân = 0
số hạng ứng với X = G \(\Rightarrow\)L = 4 ; J = | L+ S | \(\Rightarrow\)J = |4+ 0| = 4 và J = | 4 - 0| = 4
nên số hạng 2G ứng với trạng thái 2G4
*/số hạng 6S \(\Rightarrow\) 2S + 1 = 6 \(\Rightarrow\)đội bội : S = \(\frac{5}{2}\) ; mặt khác S = \(\frac{N}{2}\) \(\Rightarrow\)N = 5 vậy số e độc thân = 5
số hạng ứng với X = S \(\Rightarrow\)L = 0 ; J = | L+ S | \(\Rightarrow\)J = | 0+\(\frac{5}{2}\)| =\(\frac{5}{2}\) và J = | 0-\(\frac{5}{2}\)| = \(\frac{5}{2}\)
nên số hạng 6S ứng với trạng thái 6S\(\frac{5}{2}\)

Chọn đáp án C
Các cặp chất phản ứng với nhau ở nhiệt độ thường là :
(1) Li + N2 (2) Hg + S (3) NO + O2 (6) Ca + H2O (7) Cl2(k) + H2(k) (8) Ag + O3
Chú ý : Với các cặp (4) Mg + N2 và (5) H2 + O2 phải cần có nhiệt độ.

Chọn đáp án C
Các cặp chất phản ứng với nhau ở nhệt độ thường là:
(1) Li + N2 (2) Hg + S (3) NO + O2 + H2O (6) Ca + H2O
(7) Cl2(k) + H2(k) (8) Ag + O

n(O2)= 5.04/22.4 =0.225 (mol)
do sau pư chất rắn A td với Hcl tạo chất khí H2 nên trong A còn kim loại X còn dư nên trong pư (1) số mol tính theo O2
(1) 4X + n O2 = 2 X2On
0.9/n <= 0.225 => 0.45/n (mol)
nHCl = 1.8/2= 0.9 (mol)
2A(dư) + 2n HCl = 2 ACln + n H2
1.8/n <= 0.9 (mol)
suy ra tổng số mol kim loại X ban đầu là nX= 0.9/n + 1.8/n =2.7/n ( mol)
M(X) = 24.3 /( 2.7/n) =9n
+) n=1 thì MX = 9 (loại)
+) n=2 thì MX= 18 (loại)
+) n=3 thì MX= 27 (Al)
Vậy kim loại là nhôm nhé
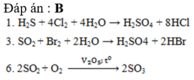

Đáp án đúng : C