Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phương trình hóa học:
2CuO + C → 2Cu + CO 2
2PbO + C → 2Pb + CO 2
CO 2 + Ca OH 2 → CaCO 3 + H 2 O
n CaCO 3 = 7,5/100 = 0,075
n C u O = x; n P b O = y

Ta có các phương trình: 80x + 223y = 19,15 (I)
x/2 + y/2 = 0,075 (l)
Giải phương trình (I), (II), ta được: X =0,1 ; Y=0,05
m CuO = 8g; m PbO = 11,15g
Vậy CuO chiếm 8/19,15 x 100% = 41% khối lượng hỗn hợp đầu, còn PbO chiếm: 59%

_Nung nóng hỗn hợp gồm CuO và PbO bằng C:
Gọi a,b là số mol của CuO và PbO:
=>80a+223b=19.15(1)
2CuO+C(t*)=>2Cu+CO2
a------->0.5a--->a--->0.5a(mol)
2PbO+C(t*)=>2Pb+CO2
b------>0.5b---->b---->0.5b(mol)
_Cho CO2 sản phẩm vào dd Ca(OH)2 thu được kết tủa trắng CaCO3:
+nCaCO3=7.5/100=0.075(mol)
CO2+Ca(OH)2=>CaCO3+H2O
0.075---------------->0.075(mol)
=>0.5a+0.5b=0.075(2)
Từ(1)(2)=>a=0.1,b=0.05
=>mCuO=0.1*80=8(g)
=>mPbO=0.05*223=11.15(g)
+nCu=0.1(mol)
=>mCu=0.1*64=6.4(g)
+nPb=0.05(mol)
=>mPb=0.05*207=10.35(g)
=>m(KL)=6.4+10.35=16.75(g)
c)
+nC=0.5(a+b)=0.5(0.1+0.05)=0.075(mol)
=>mC=0.075*12=0.9(g)

a,\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3+H_2O\)
\(n_{CaCO3}=n_{CO2}=0,075\left(mol\right)\)
\(2CuO+C\underrightarrow{^{to}}Cu+CO_2\)
a______0,5a__a_____0,5a
\(2PbO+C\underrightarrow{^{to}}Pb+CO_2\)
b_____0,5b___b___0,5b
Giải hệ PT:
\(\left\{{}\begin{matrix}80a+233b=19,15\\0,5a+0,5b=0,075\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a=0,1\\b=0,05\end{matrix}\right.\)
\(\%_{CuO}=\frac{0,1.80.100}{19,15}=41,78\%\)
\(\%_{PbO}=100\%-41,78\%=58,22\%\)
\(m_{Cu}=64a=6,4\left(g\right)\)
\(m_{Pb}=207b=10,35\left(g\right)\)
b, \(n_C=0,5.\left(a+b\right)=0,075\left(mol\right)\)
\(\Rightarrow m_C=0,9\left(g\right)\)
a) - nCuO = x ; nPbO= y
=> mhh = 80x +223y=19.15 (1)
- Bảo toàn C : nCO2 = nCaCO3 =0.075
- Bảo toàn O => x+y = 2 nCO2 = 0.15 (2)
- (1) + (2) => x=0.1 , y= 0.05
=> %mCuO = 41.78% ; %mPbO = 58.22%
- mCu = 6.4 g ; mPb= 10.35
b) - nC= nCO2 = 0.075
=> mC= 0.9g

Gọi $n_{CuO} = a; n_{PbO} = b$
Ta có :
$80a + 223b = 15,15(1)$
$CuO + CO \xrightarrow{t^o} Cu + CO_2$
$PbO + CO \xrightarrow{t^o} Pb + CO_2$
$CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O$
Theo PTHH :
$n_{CO_2} = a + b = \dfrac{10}{100} = 0,1(2)$
Từ (1)(2) suy ra a = b = 0,05
Vậy :
$m_{CuO} = 0,05.80 = 4(gam)$
$m_{PbO} = 0,05.223 = 11,15(gam)$

\(n_{CO2}=n_{CaCO3}=\frac{5,5}{100}=0,055\left(mol\right)\)
\(2CuO+C\underrightarrow{^{to}}2Cu+CO_2\)
\(2PbO+C\underrightarrow{^{to}}2Pb+CO_2\)
Đặt a là mol CuO, b là mol PbO
Ta có hệ:
\(80a+223b=10,23;0,5a+0,5b=0,055\)
\(\rightarrow\left\{{}\begin{matrix}a=0,1\\b=0,01\end{matrix}\right.\)
\(\%_{CuO}=\frac{80.0,1.100}{10,23}=78,2\%\)
\(\%PbO=100\%-78,2\%=21,8\%\)

m rắn giảm = mO (oxit) => nO (oxit) = (1,6 – 1,408) : 16 = 0,012mol
Dễ thấy n = nO (oxit) = 0,012mol
=> nH2 ban đầu = 0,012 : 80% = 0,015
=> nFe = nH2= 0,015 → x = 0,015
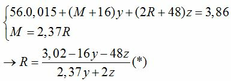
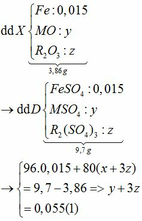
Ta có: CO + O(Oxit) → CO2
Vì: m(Rắn giảm) = mO(Oxit) → nO(Oxit) = (3,86 – 3,46) : 16 = 0,025
TH1: cả 2 oxit đều bị khử bởi CO
→ nO(Oxit) = y + 3z = 0,025 kết hợp với (1) loại
TH2: chỉ có MO bị khử bởi CO
→ nO(Oxit) = nMO = 0,025 → y = 0,025 kết hợp với (1) => z = 0,01
Kết hợp với (*) => M = 64 (Cu)
TH3: chỉ có R2O3 bị khử bởi CO
→ nO(Oxit) = 3.nR2O3 → z = 0,025/3 kết hợp với (1) => y = 0,03
Kết hợp với (*) y => M lẻ => loại
Vậy %m các chất trong X là: 21,76%; 51,81%; 26,43%
m C cần dùng = 0,9g