Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

KClO3 ---> KCl + 3/2O2
2KMnO4 ---> K2MnO4 + MnO2 + O2
Gọi x, y tương ứng là số mol của KClO3 và KMnO4.
Sau khi nung các chất còn lại bằng nhau. Theo định luật bảo toàn khối lượng ----> A/B = 1/1 = 1.
A/B = 122,5x/158y = 1 ---> x/y = 158/122,5.
---> VO2(1):VO2(2) = 1,5x/0,5y = 3.x/y = 3,87.

Định hướng tư duy giải
Ta có:
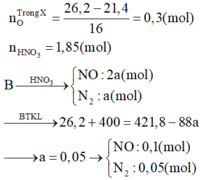

Chất tan trong bình gồm hỗn hợp muối và HNO3 dư.

Chọn đáp án C
Xử lí dữ kiện Z: Bảo toàn khối lượng:
![]()
![]()
→ n C O 2 = 0 , 09 mol ⇒ n C = 0 , 09 mol.
![]()
→ n H 2 O = 0 , 12 mol ⇒ n H = 0 , 24 mol.
![]()
![]()
⇒ n O = 0 , 09 m o l
⇒ C : H : O = 0 , 09 : 0 , 24 : 0 , 09 = 3 : 8 : 3 ⇒ Z là C3H8O3.
Ta có phản ứng Dumas: -COONa + NaOH → -H + Na2CO3 (vôi tôi xút).
![]()
![]()
M K = 0 , 625 x 32 = 20 g/mol ⇒ K gồm 2 khí trong đó có CH4.
Mà sau khi dẫn qua dung dịch Br2 dư chỉ còn 1 khí thoát ra ⇒ khí còn lại bị hấp thụ.

Đáp án B
Từ mKCl = 0,894g => mY = 10,994g
Đặt nO2 tạo ra = x => nkk = 3x có nO2 = 0,75x và nN2 = 2,25x (mol)
, nCO2 = nC = 0,044 mol => nO2 dư = (x + 0,75x) – 0,044 (mol)
=> nT = nCO2.100/22,92 = nO2 dư + nN2 + nCO2
=> 1,75x – 0,044 + 2,25x + 0,044 = 0,192
=> x = 0,048 mol
=> m = mY + mO2 tạo ra = 12,53g
=>B

Đáp án : B
Xét 1 mol không khí : 0,2 mol O2 và 0,8 mol N2
%nN2 = 84,77% => nY = 0,94373 mol
=> nSO2 = 0,1 mol
,nO2 dư = 0,0437 mol
=> nO2 pứ = 0,2 – 0,044 = 0,1563 mol
2FeS + 3,5O2 -> Fe2O3 + 2SO2
.a -> 1,75a
2FeS2 + 5,5O2 -> Fe2O3 + 4SO2
.b -> 2,75b
=> ¼ (7a + 11b) = 0,1563
.a + 2b = 0,1
=> a = 0,05 mol ; b = 0,025 mol
=> mX = 7,4g
=> %mFeS = 59,46%
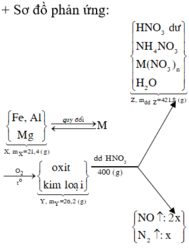



Sửa đề là nung KClO3 và KMnO4
\(2KClO_3\left(x\right)\rightarrow2KCl\left(x\right)+3O_2\left(1,5x\right)\)
\(2KMnO_4\left(y\right)\rightarrow K_2MnO_4\left(0,5y\right)+MnO_2\left(0,5y\right)+O_2\left(0,5y\right)\)
Gọi số mol của KClO3 và KMnO4 là x, y
\(\Rightarrow74,5x=98,5y+43,5y\)
\(\Leftrightarrow x=\frac{284}{149}y\)
Ta có: \(\frac{A}{B}=\frac{122,5x}{158y}=\frac{122,5.\frac{284y}{149}}{158y}=1,4778\)
b/ \(\frac{V_1}{V_2}=\frac{1,5x}{0,5y}=\frac{1,5.\frac{284}{149}x}{0,5y}=5,7181\)