Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Quy đổi hỗn hợp X : Cu: a mol, O: b mol
⇒ 64a+16b=35,6 (1)
nSO2=\(\dfrac{6,72}{22,4}=0,3\) mol
Cu→Cu2+ + 2e
a → 2a
O + 2e → O2-
b → 2b
S6+ + 2e → S4+
0,6 ← 0,3
Bte: 2a - 2b=0,6 (2)
Từ (1), (2) ⇒\(\left\{{}\begin{matrix}a=0,505\\b=0,205\end{matrix}\right.\)
⇒ m= 0,505 . 64 = 32,32g
Quy đổi hh gồm Cu (a mol) và O (b mol)
Theo bài ra: \(64a+16b=35,6\) (1)
Ta có: \(n_{SO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Bảo toàn electron: \(2n_{Cu}=2n_O+2n_{SO_2}\) \(\Rightarrow2a-2b=0,6\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,505\\b=0,205\end{matrix}\right.\)
\(\Rightarrow m_{Cu}=0,505\cdot64=32,32\left(g\right)\)
\(\Rightarrow\) Đáp án B

Đáp án B
Vì Al, Fe2O3, Fe3O4 có cùng số mol nên
![]()
Ý nung hỗn hợp trong điều kiện không có không khí chỉ dùng để đánh lạc hướng. Bài này ta chỉ cần sử dụng phương pháp bảo toàn electron.
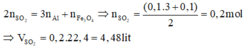

Đáp án B
Vì Al, Fe2O3, Fe3O4 có cùng số mol nên
![]()
Ý nung hỗn hợp trong điều kiện không có không khí chỉ dùng để đánh lạc hướng.Bài này ta chỉ cần sử dụng phương pháp bảo toàn electron.
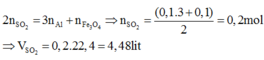

Theo gt ta có: $n_{Mg}=0,16(mol);n_{Al}=0,08(mol);n_{khi}=0,07(mol)$
Bảo toàn e ta có: $n_{e}=0,56(mol)$
$\Rightarrow e=8$
Vậy chất khử X là $H_2S$
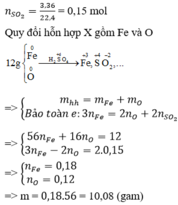






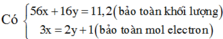
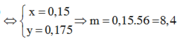
Khí thoát ra : NO2
Coi hỗn hợp X gồm Fe,O
Ta có :
\(n_{Fe} = \dfrac{7,28}{56} =0,13(mol) ; n_{NO_2} = \dfrac{1,568}{22,4} =0,07(mol)\)
Bảo toàn e :
\(3n_{Fe} = 2n_O + n_{NO_2}\Rightarrow n_O = \dfrac{0,13.3-0,07}{2} =0,16 \ mol\)
Suy ra : \(m_X = m_{Fe} + m_O = 7,28 + 0,16.16 = 9,84(gam)\)