Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
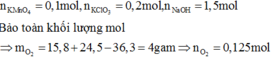
Khi cho hỗn hợp Y phản ứng với HCl đặc sẽ xảy ra phản ứng oxi hóa – khử tạo ra Cl2
![]()
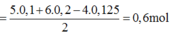


Theo đề bài, sắt còn dư sau khi phản ứng với lưu huỳnh
PTHH: \(Fe+S\underrightarrow{t^o}FeS\) (1)
\(FeS+2HCl\rightarrow FeCl_2+H_2S\uparrow\) (2)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\) (3)
Ta có: \(n_{hhkhí}=\dfrac{2,688}{22,4}=0,12\left(mol\right)=n_{Fe\left(3\right)}+n_{FeS}=\Sigma n_{Fe}\)
\(\Rightarrow m_{Fe}=0,12\cdot56=6,72\left(g\right)\)

Áp dụng định luật bảo toàn khối lượng
mkhí A = mO2 = 98 - 93,2 = 4.8 (g)
⇔ nO2 = 0.15 (mol)
X + A ⇔ \(X\left\{{}\begin{matrix}Fe:a\\Mg:b\end{matrix}\right.\)(mol) + 0,15 mol O2 \(\underrightarrow{100\%}\) 15,6g chất rắn
⇔ mX = 56a + 24b = 15,6 - 0,15 . 32 = 10.8
15,6g Y \(\left\{{}\begin{matrix}Mg,Fe\\oxit\end{matrix}\right.\) ⇔ 15,6g \(\left\{{}\begin{matrix}Mg:a\\Fe:b\\O:0.3\end{matrix}\right.\) (mol)
Quá trình oxi hóa ________________ Quá trình khử
Mgo → Mg+2 + 2e O0 + 2e ⇒ O-2
a .................... 2a 0,3 ...... 0,6
Fe0 → Fe+3 + 3e S+6 + 2e → S+4
b ................... 3b 0.05 ← 0.025
Vậy 2a + 3b = 0,65
Giải ra a,b

Em có thể tham khảo cách giải sau:
Ta có: mO2 = (15,8 + 24,5)-36,3 = 4 gam. => nO2 = 0,125 mol.
nKMnO4 = 0,1 mol, nKClO3 = 0,2 mol.
Mn7+ + 5e -> Mn2+
Cl5+ + 6e -> Cl-1
2O2- -> O2 + 4e
2Cl-1 -> Cl2 + 2e
Bảo toàn electron, ta có: 0,1*5 + 0,2*6 = 0,125*4 + 2*nCl2
=> nCl2 =0,6 mol.
3Cl2 + 6NaOH -> 5NaCl + NaClO3 + 3H2O (vì đun nóng).
Bđ 0,6 1,5
P/ư 0,6 1,2 1,0 0,2
Sau p/ư 0 0,3 1,0 0,2.
=> m Rắn =0,3*40 + 1,0*58,5 + 0,2*106,5 = 91,8 gam.

Đáp án C
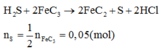
Chú ý: Không tồn tại muối sunfua của Al và Fe(III). H2S không phản ứng với AlCl3 nhưng nếu
![]()
Có sự khác nhau này do Fe3+ có tính oxi hóa mạnh còn Al3+ tính oxi hóa yếu

\(n_{KMnO_4}=\dfrac{15,8}{158}=0,1\left(mol\right)\)
PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
a-------------->0,5a----->0,5a
=> 158(0,1-a) + 197.0,5a + 87.0,5a = 14,84
=> a = 0,06 (mol)
PTHH: 2KMnO4 + 16HCl --> 2KCl + 2MnCl2 + 5Cl2 + 8H2O
0,04----------------------------------->0,1
K2MnO4 + 8HCl --> 2KCl + MnCl2 + 2Cl2 + 4H2O
0,03--------------------------------->0,06
MnO2 + 4HCl --> MnCl2 + Cl2 + 2H2O
0,03--------------------->0,03
=> \(n_{Cl_2}=0,1+0,06+0,03=0,19\left(mol\right)\)
=> \(V_{Cl_2}=0,19.22,4=4,256\left(l\right)\)

Quy đổi hỗn hợp X : Cu: a mol, O: b mol
⇒ 64a+16b=35,6 (1)
nSO2=\(\dfrac{6,72}{22,4}=0,3\) mol
Cu→Cu2+ + 2e
a → 2a
O + 2e → O2-
b → 2b
S6+ + 2e → S4+
0,6 ← 0,3
Bte: 2a - 2b=0,6 (2)
Từ (1), (2) ⇒\(\left\{{}\begin{matrix}a=0,505\\b=0,205\end{matrix}\right.\)
⇒ m= 0,505 . 64 = 32,32g
Quy đổi hh gồm Cu (a mol) và O (b mol)
Theo bài ra: \(64a+16b=35,6\) (1)
Ta có: \(n_{SO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Bảo toàn electron: \(2n_{Cu}=2n_O+2n_{SO_2}\) \(\Rightarrow2a-2b=0,6\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,505\\b=0,205\end{matrix}\right.\)
\(\Rightarrow m_{Cu}=0,505\cdot64=32,32\left(g\right)\)
\(\Rightarrow\) Đáp án B


Khi nhiệt phân KMnO4, phần khí O2 sinh ra bay hơi nên lượng chất rắn còn lại gồm KMnO4 dư, K2MnO4 và MnO2. Dựa vào định luật bảo toàn khối lượng dễ dàng tìm được khối lượng O2. Xét sự thay đổi số oxi hóa của các nguyên tố trong toàn bộ quá trình, chỉ có Mn, O và Cl thay đổi số oxi hóa. Dựa vào định luật bảo toàn electron với số mol Mn và O đã biết ta suy ra được số mol electron Cl- đã nhận.
Chất rắn bao gồm K2MnO4 và MnO2
BTKL:
Khi cho chất rắn phản ứng với HCl sẽ xảy ra phản ứng oxi hóa – khử.
Khí X chính là Cl2.
Sử dụng định luật bảo toàn electron cho toàn bộ quá trình, ta có các bán phản ứng:
Phản ứng điều chế clorua vôi CaOCl2:
Khối lượng clorua vôi theo lý thuyết:
Clorua vôi này chứa 30% tạp chất tức là clorua vôi nguyên chất chỉ chiếm 70%.
Khối lượng clorua vôi thực tế thu được:
ghi nguồn copy ra bạn ơi !