Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án B
● Ta có: nBa2+ = 0,3 mol và ∑nSO42– = 0,35 mol.
⇒ nBaSO4 = 0,3 mol ⇒ mBaSO4 = 0,3 × 233 = 69,9 gam.
● Ta có ∑nOH– = 0,8 mol. và nZn2+ = 0,25 mol.
⇒ nZn(OH)2 = 4nZn2+ – ∑nOH– = 0,2 mol.
⇒ mZn(OH)2 = 0,2 × 99 = 19,8 gam.
⇒ Tổng khối lượng kết tủa = 69,9 + 19,8 = 89,7 gam

Đáp án B
Xét NaOH +X
tạo 0,52 mol NaCl và 0,14 mol N a 2 S O 4 và dư 0,05 mol N a +
Ghép với A l O 2 - ⇒ tạo 0,05 mol N a A l O 2
Đặt n A l = x ; n M g = y
![]()
![]()
Giải hệ có: ![]()
![]()
TH1: B a S O 4 đạt cực đại
⇒ n B a ( O H ) 2 = n S O 4 = 0 , 14 m o l
⇒ n K O H = 0 , 14 . 8 = 1 , 12 m o l
Ghép tương tự NaOH, ta thấy B a 2 + , K + , S O 4 2 - , C l - còn dư 0,6 mol điện tích
Ghép với A l O 2 - ⇒ ghép được 0,15 mol
⇒ vẫn chưa đủ ⇒ còn O H - dư
Rắn gồm 0,14 mol B a S O 4 ; 0 , 15 m o l M g O ⇒ mrắn =38,62g
TH2: A l ( O H ) 3 đạt cực đại
⇒ các ion trong dung dịch gồm B a 2 + , K + , S O 4 2 - , C l -
(ta đang giả sử B a 2 + , S O 4 2 - cùng tồn tại trong cùng 1 dung dịch)
Đặt n B a 2 + = a ⇒ n K + = 8 a
Bảo toàn điện tích:
![]()
n B a S O 4 = n B a 2 + = 0 , 08 m o l
![]()
![]()
⇒ mrắn tối đa =38,62 (g)

Đáp án B
• ![]()
• Đặt số mol Mg, Al lần lượt là a, b => 24a + 27b = 7,65 g (1)
Có n NaOH = 0 , 85 > 0 , 52 + 2 . 0 , 14 = 0 , 8
=> Chứng tỏ Al(OH)3 bị hòa tan một phần: n AlO 2 - = 0 , 85 - 0 , 8 = 0 , 05 mol
⇒ m ↓ = m Mg ( OH ) 2 + m Al ( OH ) 3 = 58 a + 78 . ( b - 0 , 05 ) = 16 , 5 g (2)
• Từ (1) và (2) suy ra a = b = 0,15
• Đặt V (lít) là thể tích dung dịch kiềm thêm vào.
⇒ n B a 2 + = 0 , 1 V , n OH - = ( 0 , 8 + 2 . 0 , 1 ) V = V
P Lượng hiđroxit thu được cực đại khi: n OH - = n H + ⇒ V = 0 , 8 ( l )
Khi đó: n B a 2 + = 0 , 08 mol < n SO 4 2 - = 0 , 14 mol
⇒ m ↓ = 58 . 0 , 15 + 78 . 0 , 15 + 233 . 0 , 08 = 39 , 04 g
P Lượng BaSO4 thu được cực đại khi: n Ba 2 + = n SO 2 - = 0 , 14 mol ⇒ n OH - = 1 , 4 mol
Khi đó: n OH - > n H + + n Al ⇒ Al ( OH ) 3 tan hết
⇒ m ↓ = 58 . 0 , 15 + 233 . 0 , 14 = 41 , 32 g > 39 , 04 g
=> Lượng kết tủa đạt cực đại khi V = 1,4 lít
⇒ m ↓ = m MgO + m B a S O 4 = 40 . 0 , 15 + 233 . 0 , 14 = 38 , 62 g
Gần nhất với giá trị 38,6

Giải thích:
Gọi nNa = nBa = x (mol)
nH2SO4 = 0,125 (mol); nCuSO4 = 0,125 (mol) ; nH2 = 0,15 (mol)
Ta thấy: nH2 = 0,15 (mol) > nH2SO4 => Na, Ba phản ứng hết với axit sau đó tiếp tục phản ứng với H2O
Ta có: ∑ ne (KL nhường) = ∑ n e( H2 nhận)
=> x + 2x = 0,15.2
=> x = 0,1 (mol)
=> nOH- = 2 ( nH2 – nH2SO4) = 2 ( 0,15 – 0,125) = 0,05 (mol)
=> nCu(OH)2 = ½ nOH- = 0,025 (mol)
m↓ = mCu(OH)2 + mBaSO4 = 0,025.98 + 0,1.233 = 25,75 (g)
Đáp án A

Đáp án A
Gọi nNa = nBa = x (mol)
nH2SO4 = 0,125 (mol); nCuSO4 = 0,125 (mol) ; nH2 = 0,15 (mol)
Ta thấy: nH2 = 0,15 (mol) > nH2SO4 => Na, Ba phản ứng hết với axit sau đó tiếp tục phản ứng với H2O
Ta có: ∑ ne (KL nhường) = ∑ n e( H2 nhận)
=> x + 2x = 0,15.2
=> x = 0,1 (mol)
=> nOH- = 2 ( nH2 – nH2SO4) = 2 ( 0,15 – 0,125) = 0,05 (mol)
=> nCu(OH)2 = ½ nOH- = 0,025 (mol)
m↓ = mCu(OH)2 + mBaSO4 = 0,025.98 + 0,1.233 = 25,75 (g)

Đáp án A
Gọi nNa = nBa = x (mol)
nH2SO4 = 0,125 (mol); nCuSO4 = 0,125 (mol) ; nH2 = 0,15 (mol)
Ta thấy: nH2 = 0,15 (mol) > nH2SO4
=> Na, Ba phản ứng hết với axit sau đó tiếp tục phản ứng với H2O
Ta có: ∑ ne (KL nhường) = ∑ n e( H2 nhận)
=> x + 2x = 0,15.2
=> x = 0,1 (mol)
=> nOH- = 2 ( nH2 – nH2SO4) = 2 ( 0,15 – 0,125) = 0,05 (mol)
=> nCu(OH)2 = ½ nOH- = 0,025 (mol)
m↓ = mCu(OH)2 + mBaSO4 = 0,025.98 + 0,1.233 = 25,75 (g)

Đáp án C
n(CO32–) = 0,2 mol; n(HCO3–) = 0,3 mol.
→ tỉ lệ 2 : 3.
→ 2x và 3x là số mol CO32– và HCO32– đã phản ứng
→ n(H+) = 2x.2 + 3x = 0,42 => x = 0,06 → n(CO2) = 2x + 3x = 0,3 mol.
Có n(OH–) = 0,36
Xét tỉ lệ T = n(OH–) / n(CO2) thấy tạo ra đồng thời 2 muối CO32– và HCO3–.
→ n(CO32–) = 0,06; n(HCO3–) = 0,24
n(Ba2+) = 0,08 → n(BaCO3) = 0,06 → m(BaCO3) = 11,82 gam.
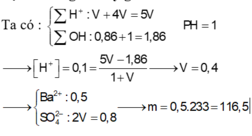

Đáp án B
nBa = nBa(OH)2 = 0,3 mol
nSO4 = nH2SO4 + nZnSO4 = 0,325 mol
nOH = 0,8 mol ; nH+ = 0,25 mol ; nZn2+ = 0,2 mol
Ba2+ + SO42- → BaSO4
0,3 → 0,3 mol
nOH (pứ Zn2+) = 0,8 – nH+ = 0,55 mol
=> nOH : nZn2+ = 2,75 => Kết tủa hòa tan 1 phần
=> nZn(OH)2 = 2 nZn2+ – 0,5 nOH = 0,125 mol
=> m = 82,275g