Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) PTHH: \(Cu\left(OH\right)_2\xrightarrow[]{t^o}CuO+H_2O\)
Ta có: \(n_{CuO}=\dfrac{4}{80}=0,05\left(mol\right)=n_{Cu\left(OH\right)_2}\) \(\Rightarrow m_{Cu\left(OH\right)_2}=0,05\cdot98=4,9\left(g\right)\)
b) PTHH: \(Cu\left(OH\right)_2+H_2SO_4\rightarrow CuSO_4+2H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{Cu\left(OH\right)_2}=0,05\left(mol\right)\\n_{H_2SO_4}=\dfrac{250\cdot9,8\%}{98}=0,25\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Axit còn dư
\(\Rightarrow\left\{{}\begin{matrix}n_{CuSO_4}=0,05\left(mol\right)\\n_{H_2SO_4\left(dư\right)}=0,2\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}C\%_{CuSO_4}=\dfrac{0,05\cdot160}{4,9+250}\cdot100\%\approx3,14\%\\C\%_{H_2SO_4\left(dư\right)}=\dfrac{0,2\cdot98}{4,9+250}\cdot100\%\approx7,7\%\end{matrix}\right.\)

2Fe(OH)3 -----to---> Fe2O3 + 3H2O
Mg(OH)2 ----to---> MgO + H2O
Gọi x, y lần lượt là số mol Fe(OH)3 và Mg(OH)2
\(\left\{{}\begin{matrix}107x+58y=16,5\\\dfrac{1}{2}.160x+y.40=12\end{matrix}\right.\)
=> x=0,1 ; y=0,1
\(\%m_{Fe\left(OH\right)_3}=\dfrac{107.0,1}{16,5}.100=64,85\%\)
%Mg(OH)2 = 35,15%
b) \(2Fe\left(OH\right)_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+6H_2O\)
0,1----------------------------------->0,05
\(Mg\left(OH\right)_2+H_2SO_4\rightarrow MgSO_4+2H_2O\)
0,1------------------------------------>0,1
\(m_{ddsaupu}=16,5+200=216,5\left(g\right)\)
\(C\%_{Fe_2\left(SO_4\right)_3}=\dfrac{0,05.400}{216,5}.100=9,24\%\)
\(C\%_{MgSO_4}=\dfrac{0,1.12}{216,5}.100=5,54\%\)

a)
Cu(OH)2 ➝ CuO + H2O (2)
CuO + H2SO4➝ CuSO4 + H2O (1)
Đổi : 100ml= 0,1lít
Số mol axit sunfuric cần dùng là:
n= CM . V = 0,1 . 2=0,2 mol
Từ (1) ➜ nH2SO4= nCuO= 0,2mol
Khối lượng CuO đã nhiệt phân là:
m= n.M= 0,2. 80=16 (g)
Từ (2)➜nCu(OH)2= nCuO=0,2 mol
Khối lượng đồng hiđroxit đã dùng là:
m= n.M = 0,2.98=19,6 (g)
b)
Từ (1)➙ nCuSO4=nCuO= 0.2mol
Khối lượng muối thu được là:
m=n.M= 0,2 . 160=32 (g)
O

a) PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
Ta có: \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)=n_{Fe}=n_{FeCl_2}\) \(\Rightarrow\left\{{}\begin{matrix}C\%_{FeCl_2}=\dfrac{0,15\cdot127}{300}\cdot100\%=6,35\%\\m_{Fe}=0,15\cdot56=8,4\left(g\right)\end{matrix}\right.\)
b) PTHH: \(Cu+2H_2SO_{4\left(đ\right)}\xrightarrow[]{t^o}CuSO_4+SO_2\uparrow+2H_2O\)
Ta có: \(n_{Cu}=\dfrac{13,2-8,4}{64}=0,075\left(mol\right)=n_{SO_2}\) \(\Rightarrow V_{SO_2}=0,075\cdot22,4=1,68\left(l\right)\)


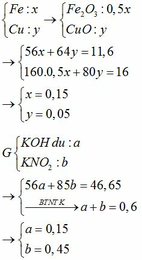
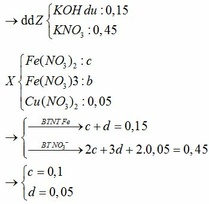

BTKL
mX + mdd HNO3 = mdd X + mH2O + m↑
=> mdd X = 11,6 + 87,5 – 30 . 0,1 – 46 . 0,15 = 89,2g
=> C%Fe(NO3)3 = 13,565%

