
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


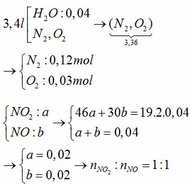
Tỉ lệ mol của 2 khí NO2 và NO là 1:1, khí O2 không đủ nên giả sử mol pứ đều là: x (mol)
2NO2 + ½ O2 + H2O → 2HNO3
x→ 0,25x x
2NO + 1,5O2 + H2O → 2HNO3
x → 0,75x x
pứ: x 2x
nO2 = 0,03 => x = 0,03
=> nHNO3 = 0,06
mbình sau pứ = N2 + mO2 + mH2O+ mNO2 + mNO = 28 . 0,12 + 32 . 0,03 + 40 + 19 . 2 . 0,04 = 45,84g
=> %HNO3 = 8,246%

a, Ta có : \(n_{CO2}=\dfrac{V}{22,4}=0,1\left(mol\right)\)
\(BTNT\left(C\right):n_{MgCO3}=n_{CO2}=0,1\left(mol\right)\)
\(\Rightarrow m_{MgCO3}=n.M=8,4\left(g\right)\)
\(\Rightarrow m_{MgO}=8\left(g\right)\)
b, Thấy sau khi phản ứng xảy ra thu được dung dịch A gồm \(MgSO_4\) và có thể còn \(H_2SO_4\) dư .
\(BTNT\left(Mg\right):n_{MgSO_4}=n_{MgCO3}+n_{MgO}=0,3\left(mol\right)\)
\(PTHH:MgSO_4+Ba\left(OH\right)_2\rightarrow Mg\left(OH\right)_2\downarrow+BaSO_4\downarrow\)
.................0,3............0,3..................0,3..................0,3.............
\(\Rightarrow m_{\downarrow}=m_{Mg\left(OH\right)2}+m_{BaSO4}=87,3\left(g\right)\)
Mà \(\left\{{}\begin{matrix}m\downarrow=110,6\left(g\right)>87,3g\\n_{Ba\left(OH\right)2}=C_M.V=0,45>n_{Ba\left(OH\right)2pu}\left(0,3mol\right)\end{matrix}\right.\)
=> Dung dịch A vẫn còn H2SO4 dư và mol BaSO4 được tạo ra tiếp là :
\(n_{BaSO4}=\dfrac{110,6-87,3}{M}=0,1\left(mol\right)\)
\(PTHH:H_2SO_4+Ba\left(OH\right)_2\rightarrow BaSO_4+2H_2O\)
..................0,1............0,1...............0,1........................
Lại có : \(n_{Ba\left(OH\right)2}=0,45\left(mol\right)\)
=> Trong dung dịch B còn có Ba(OH)2 dư ( dư 0,45 - 0,3 - 0,1 = 0,05mol)
\(\Rightarrow C_{MBa\left(OH\right)2}=\dfrac{n}{V}=\dfrac{0,05}{0,5}=0,1\left(M\right)\)
Vậy ...

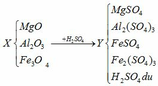
(a) Hòa tan MgO, Al2O3 và Fe3O4 vào H2SO4:
(1) MgO + H2SO4 → MgSO4 + H2O
(2) Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
(3) Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O
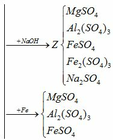
Trung hòa Y:
(4) H2SO4 + 2NaOH → Na2SO4 + 2H2O
Cho dung dịch Y (MgSO4, Al2(SO4)3, FeSO4, Fe2(SO4)3, H2SO4) qua cột chứa bột sắt:
(5) H2SO4 + Fe → FeSO4 + H2
(6) Fe2(SO4)3 + Fe → 3FeSO4
(b) nH2SO4 = 0,45.1 = 0,45 mol
Gọi số mol của MgO, Al2O3 và Fe3O4 trong hỗn hợp ban đầu lần lượt là x, y, z (mol)
Ta có: 40x + 102y + 232z = 20,68 (*)
- Khi hòa tan hỗn hợp vào H2SO4:
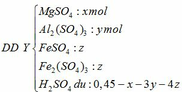
- Trung hòa ¼ dung dịch Y cần 0,025 mol NaOH vậy trung hòa Y cần 0,1 mol NaOH:
Theo PTHH (4): nH2SO4 dư = 0,5nNaOH = 0,05 mol
=> 0,45 – x – 3y – 4z = 0,05
=> x + 3y + 4z = 0,4 (**)
Dung dịch thu được chứa các chất:
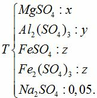
- Giả sử dẫn toàn bộ dung dịch Y qua cột chứa bột Fe:
(5) H2SO4 + Fe → FeSO4 + H2
0,05 → 0,05 (mol)
(6) Fe2(SO4)3 + Fe → 3FeSO4
z → 3z (mol)
Dung dịch sau chứa các chất tan:
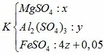
Theo đề bài ta có: mK – mT = 4.1,105
=> [120x + 342y + 152(4z + 0,05)] – [120x + 342y + 152.z + 400z + 0,05.142] = 4,42
=> z = 0,07 (***)
Từ (*) (**) (***) ta giải được z = 0,06; y = 0,02; z = 0,07
Số mol của nguyên tố O trong hỗn hợp X:
nO = nMgO + 3nAl2O3 + 4nFe3O4 = 0,06 + 3.0,02 + 4.0,07 = 0,4 mol
Khối lượng của O: mO = 0,4.16 = 6,4 (gam)
Phần trăm khối lượng của nguyên tố O:



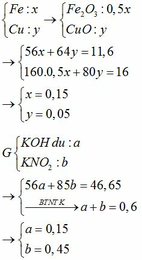
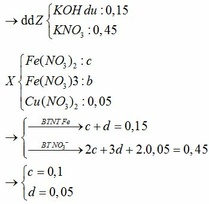

BTKL
mX + mdd HNO3 = mdd X + mH2O + m↑
=> mdd X = 11,6 + 87,5 – 30 . 0,1 – 46 . 0,15 = 89,2g
=> C%Fe(NO3)3 = 13,565%

PTHH: \(CaO+2HCl\rightarrow CaCl_2+H_2O\) (1)
\(CaCO_3+2HCl\rightarrow CaCl_2+H_2O+CO_2\uparrow\) (2)
a) Ta có: \(n_{CO_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)=n_{CaCO_3}\)
\(\Rightarrow m_{CaCO_3}=0,2\cdot100=20\left(g\right)\) \(\Rightarrow\%m_{CaCO_3}=\dfrac{20}{25,6}\cdot100\%=78,125\%\)
\(\Rightarrow\%m_{CaO}=21,875\%\)
b) Theo 2 PTHH: \(\left\{{}\begin{matrix}n_{HCl\left(2\right)}=2n_{CaCO_3}=0,4mol\\n_{HCl\left(1\right)}=2n_{CaO}=2\cdot\dfrac{25,6-20}{56}=0,2mol\end{matrix}\right.\)
\(\Rightarrow\Sigma n_{HCl}=0,6mol\) \(\Rightarrow C\%_{HCl}=\dfrac{0,6\cdot36,5}{210\cdot1,05}\cdot100\%\approx9,93\%\)