Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, Cứ 1 mol sắt tan trong dd thì sẽ có 1 mol Cu bám vào thanh sắt ⇒ Khối lượng tăng 8g
Vậy khi khối lượng tăng 0,8g thì nCu = nFe = 0.1 (mol)
⇒ mCu trên thanh sắt = 6,4 (g)
b, Các chất tan trong A: CuSO4; FeSO4
V = 500 ml = 0,5 (l)
nCuSO4 ban đầu = 0,5 (mol)
nCuSO4 phản ứng = 0,1 (mol)
⇒ nCuSO4 trong dd = 0,4 (mol)
⇒ CMCuSO4 = 0.8 (M)
nFeSO4 = nFe = 0,1 (mol)
⇒ CMFeSO4 = 0,2 (M)
PTHH: \(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
a) Gọi số mol Fe phản ứng là \(x\) \(\Rightarrow n_{Cu}=x\left(mol\right)\)
Ta có: \(64x-56x=0,8\) \(\Leftrightarrow x=0,1\)
\(\Rightarrow m_{Cu\left(bámvào\right)}=0,1\cdot64=6,4\left(g\right)\)
b) Ta có: \(n_{CuSO_4}=0,5\cdot1=0,5\left(mol\right)\)
\(\Rightarrow n_{CuSO_4\left(dư\right)}=0,5-0,1=0,4\left(mol\right)\)
Mặt khác: \(n_{FeSO_4}=0,1mol\)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{CuSO_4}}=\dfrac{0,4}{0,5}=0,8\left(M\right)\\C_{M_{FeSO_4}}=\dfrac{0,1}{0,5}=0,2\left(M\right)\end{matrix}\right.\)

1) Ptpư:
2Al + 6HCl \(\rightarrow\) 2AlCl3 + 3H2
Fe + 2HCl \(\rightarrow\) FeCl2 + H2
Cu + HCl \(\rightarrow\) không phản ứng
=> 0,6 gam chất rắn còn lại chính là Cu:
Gọi x, y lần lượt là số mol Al, Fe
Ta có:
3x + 2y = 2.0,06 = 0,12
27x + 56 y = 2,25 – 0,6 = 1,65
=> x = 0,03 (mol) ; y = 0,015 (mol)
=> \(\%Cu=\frac{0,6}{2,25}.100\%=26,67\%\); \(\%Fe=\frac{56.0,015}{2,25}.100\%=37,33\%\); %Al = 36%
2) \(n_{SO_2}=\frac{1,344}{22,4}=0,06mol\); m (dd KOH) = 13,95.1,147 = 16 (gam)
=> mKOH = 0,28.16 = 4,48 (gam)=> nKOH = 0,08 (mol)=> \(1<\)\(\frac{n_{KOH}}{n_{SO_2}}<2\)
=> tạo ra hỗn hợp 2 muối: KHSO3: 0,04 (mol) và K2SO3: 0,02 (mol)
Khối lượng dung dịch sau pu = 16 + 0,06.64 = 19,84 gam
=> \(C\%\left(KHSO_3\right)=\frac{0,04.120}{19,84}.100\%\)\(=24,19\%\)
\(C\%\left(K_2SO_3\right)=\frac{0,02.158}{19,84}.100\%\)\(=15,93\%\)

a) Gọi kim loại cần tìm là M
\(m_{M\left(pư\right)}=\dfrac{50.1,68}{100}=0,84\left(g\right)\)
\(n_{H_2}=\dfrac{0,336}{22,4}=0,015\left(mol\right)\)
PTHH: 2M + 2xHCl --> 2MClx + xH2
\(\dfrac{0,03}{x}\) <--------------------0,015
=> \(M_M=\dfrac{0,84}{\dfrac{0,03}{x}}=28x\left(g/mol\right)\)
Xét x = 1 => L
Xét x = 2 => MM = 56(Fe)
b) Mình nghĩ đề thiếu dữ kiện :v

a) \(n_{H_2}=\dfrac{0,336}{22,4}=0,015\left(mol\right)\)
Gọi kim loại cần tìm là A, có hoá trị x (x:nguyên, dương)
\(2A+2xHCl\rightarrow2ACl_x+xH_2\uparrow\\ m_{giảm}=m_{kim.loại}=1,68\%.50=0,84\left(g\right)\\ n_A=\dfrac{0,015.2}{x}=\dfrac{0,03}{x}\left(mol\right)\\ \Rightarrow M_A=\dfrac{0,84}{\dfrac{0,03}{x}}=28x\left(\dfrac{g}{mol}\right)\)
Xét: x=1;x=2;x=3;x=8/3 => Nhận x=2 khi đó MA=56(g/mol)
=> A là Sắt (Fe=56)
b) Không tính được nồng độ dd muối vì không có khối lượng dung dịch HCl

Đáp án C
Vì khi thêm HCl thì khối lượng chất rắn khan thu được tăng lên nên ở lần 1 kim loại phản ứng dư và HCl hết, lần 1 có
![]() nếu ở lần 2 kim loại vẫn dư và HCl hết thì tổng số mol HCl 2 lần là 0,36 + 0,24 = 0,6
nếu ở lần 2 kim loại vẫn dư và HCl hết thì tổng số mol HCl 2 lần là 0,36 + 0,24 = 0,6
Mà 2 lần có ![]()
nên lần 2 kim loại đã phản ứng hết.



Bạn xem câu trả lời của mình nha :
a) Phương trình hóa học:
Fe + CuSO4 → FeSO4 + Cu
P/ư: x x x x mol
Khối lượng lá sắt tăng = 2,58 - 2,5 = 0,08 gam. Ta có phương trình:
64x - 56x = 0,08
x = 0,01 mol
b) Sô mol CuS04 ban đầu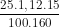 = 0,02625 mol
= 0,02625 mol
Trong dung dịch sau phản ứng có hai chất tan là FeSO4 0,01 mol và CuSO4 dư 0,01625 mol.
Khối lượng dung dịch:
mdd =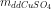 + mFe(p.ư) – mCu = 25.1,12 + 0,01.56 - 0,01.64 = 27,91 g
+ mFe(p.ư) – mCu = 25.1,12 + 0,01.56 - 0,01.64 = 27,91 g
C%, CuS04 =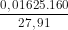 .100% ≈ 9,32%
.100% ≈ 9,32%
C%, FeSO4 =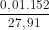 .100% ≈ 5,45%
.100% ≈ 5,45%