Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Các phản ứng xảy ra:
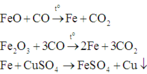
Hỗn hợp rắn thu được khi cho hỗn hợp phản ứng với dung dịch CuSO4 gồm Cu, FeO và Fe2O3.
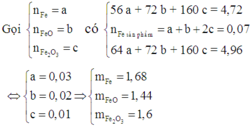

Đáp án A
Ta có dãy điện hóa: ![]()
=>Zn phản ứng với C u 2 + trước
![]() khối lượng rắn giảm
khối lượng rắn giảm
![]() khối lượng rắn tăng
khối lượng rắn tăng
Do cuối cùng m rắn = m(g) =m hỗn hợp ban đầu =>tăng và giảm phải cân bằng với nhau.
Đặt nZn = x; nFe = y => m giảm = (65 - 64)x = x(g); m tăng = (64 - 65)y = 8y
m tăng = m giảm =>x = 8y =>%mZn = 65x/(65x - 56y)x100% = 90,27%

Đáp án A
Ta có dãy điện hóa: ![]()
=>Zn phản ứng với C u 2 + trước
![]()
=> Khối lượng rắn giảm
![]() => Khối lượng rắn tăng
=> Khối lượng rắn tăng
Do cuối cùng m rắn = m(g) =m hỗn hợp ban đầu =>tăng và giảm phải cân bằng với nhau.
Đặt n Z n = x ; n F e = y => m giảm = (65 - 64)x = x(g); m tăng = (64 - 56)y = 8y
m tăng = m giảm => x = 8y => %mZn = 65x : (65x - 56y).100% = 90,27%

Đáp án B.
Gọi số mol của Zn và Fe lần lượt là x và y mol
PTHH:
Zn + CuSO4 à ZnSO4 + Cu
x à x
Fe + CuSO4 à FeSO4 + Cu
y à y
Theo bài ta có: mrắn bđ = mrắn sau ó 65x + 56y = 64x + 64y ó x = 8y.
Coi số mol của Fe là 1 mol thì số mol của Zn là 8 mol.
Thành phần phần trăm theo khối lượng của Zn trong hỗn hợp bột ban đầu là:
![]()

Đáp án A
Gọi nZn = a; nFe = b thì nCu = a + b
Vì khối lượng chất rắn trước và sau phản ứng bằng nhau nên mZn + mFe = mCu
Do đó 65a + 56b = 64(a+b) ⇔ a = 8b
Vậy phần trăm khối lượng cúa Zn trong hỗn hợp ban đầu là:
% m Z n = 65 . 8 b 65 . 8 b + 56 b . 100 % = 90 , 27 %

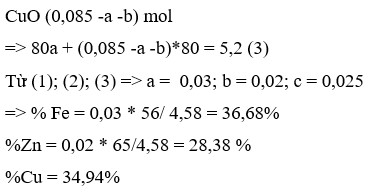
Đáp án B
Phương trình phản ứng:
m tăng = (64-56).a = 1 ⇒a=0,125 mol
nFe = 0,125 ⇒nCu = (15-56.0,125)/64 = 0,125 mol
Thành phần phần trăm theo khối lượng:
⇒ % mCu = 53,33