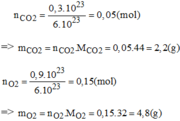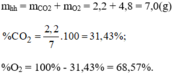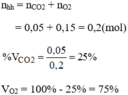Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
Dựa vào màu sắc:
+ NO: Chất khí không màu
+ NO2: Chất khí màu nâu
b)
Gọi số mol NO2, O2 là a, b (mol)
\(M=\dfrac{46a+32b}{a+b}=17,75.2=35,5\left(g/mol\right)\)
=> 10,5a = 3,5b
=> 3a = b
\(\left\{{}\begin{matrix}\%V_{NO_2}=\dfrac{a}{a+b}.100\%=\dfrac{a}{a+3a}.100\%=25\%\\\%V_{O_2}=100\%-25\%=75\%\end{matrix}\right.\)

a) Gọi nO2 =a (mol); nO3 = b(mol)
Có: \(\dfrac{32a+48b}{a+b}=20.2=40\)
=> 32a + 48b = 40a + 40b
=> 8a = 8b => a = b
=> \(\left\{{}\begin{matrix}\%V_{O_2}=\dfrac{a}{a+b}.100\%=\dfrac{a}{a+a}.100\%=50\%\\\%V_{O_3}=100\%-50\%=50\%\end{matrix}\right.\)
b) Gọi nN2 =a (mol); nNO = b(mol)
Có: \(\dfrac{28a+30b}{a+b}=14,75.2=29,5\)
=> 28a + 30b = 29,5a + 29,5b
=> 1,5a = 0,5b
=> 3a = b
=> \(\left\{{}\begin{matrix}\%V_{N_2}=\dfrac{a}{a+b}.100\%=\dfrac{a}{a+3a}.100\%=25\%\\\%V_{NO}=100\%-25\%=75\%\end{matrix}\right.\)

a)
\(V_{N_2}=\dfrac{17,92.62,5}{100}=11,2\left(l\right)\)
=> \(n_{N_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
Gọi số mol O2 là a (mol)
=> nX = 2a (mol)
Có: \(2a+a+0,5=\dfrac{17,92}{22,4}=0,8\)
=> a = 0,1 (mol)
\(\overline{M}_A=\dfrac{0,1.32+0,2.M_X+0,5.28}{0,8}=12,875.2=25,75\left(g/mol\right)\)
=> MX = 17 (g/mol)
=> X là NH3
b) \(\left\{{}\begin{matrix}\%m_{N_2}=\dfrac{0,5.28}{0,5.28+0,2.17+0,1.32}.100\%=67,961\%\\\%m_{O_2}=\dfrac{0,1.32}{0,5.28+0,2.17+0,1.32}.100\%=15,54\%\\\%m_{NH_3}=\dfrac{0,2.17}{0,5.28+0,2.17+0,1.32}.100\%=16,505\%\end{matrix}\right.\)
c) \(n_{H_2}=\dfrac{0,4}{2}=0,2\left(mol\right)\)
\(\overline{M}_B=\dfrac{0,5.28+0,2.17+0,1.32+0,4}{0,5+0,2+0,1+0,2}=21\left(g/mol\right)\)
Tính tỉ khối của B với gì vậy bn :) ?

a) \(n_X=\dfrac{6.10^{23}}{6.10^{23}}=1\left(mol\right)\)
=> \(n_Y=0,5\left(mol\right)\)
Gọi số mol NO2, CH4 là a, b
=> a + b = 0,5
Có: \(\dfrac{46a+16b+0,5.M_Y}{1}=15.2\)
=> 46a + 16b + 0,5.MY = 30
Có: \(\dfrac{16b}{46a+16b+0,5.M_Y}.100\%=16\%\)
=> b = 0,3 (mol)
=> a = 0,2 (mol)
=> MY = 32(g/mol)
Mà Y là đơn chất
=> Y là O2
b) \(n_{CH_4}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,5}{2}\)=> CH4 dư, O2 hết
=> Lượng O2 trong hỗn hợp trên không đủ để đốt cháy 6,72 lít CH4

Gọi số mol NO, NO2 lần lượt là a, b
=> \(\dfrac{30a+46b}{a+b}=17.2=34\)
=> 30a + 46b = 34a + 34b
=> 4a = 12b
=> a = 3b
=> \(\left\{{}\begin{matrix}\%V_{NO}=\dfrac{a}{a+b}.100\%=\dfrac{3b}{3b+b}.100\%=\dfrac{3}{4}.100\%=75\%\\V_{NO_2}=100\%-75\%=25\%\end{matrix}\right.\)

a. Ta có: \(n_X=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Gọi x, y lần lượt là số mol của NO và N2
Ta có: \(\overline{M_X}=\dfrac{30x+28y}{x+y}\left(g\right)\)
Mà \(d_{\dfrac{X}{O_2}}=\dfrac{\overline{M_X}}{M_{O_2}}=\dfrac{\overline{M_X}}{32}=0,9\left(lần\right)\)
=> \(\overline{M_X}=28,8\left(g\right)\)
=> \(\dfrac{30x+28y}{x+y}=28,8\left(g\right)\)
<=> \(1,2x-0,8y=0\) (*)
Theo đề, ta có: x + y = 0,25 (**)
Từ (*) và (**), ta có HPT:
\(\left\{{}\begin{matrix}1,2x-0,8y=0\\x+y=0,25\end{matrix}\right.\)
=> x = 0,1, y = 0,15
=> \(V_{NO}=0,1.22,4=2,24\left(lít\right);V_{N_2}=0,15.22,4=3,36\left(lít\right)\)
b.
\(\%_{V_{NO}}=\dfrac{2,24}{2,24+3,36}.100\%=40\%\)
\(\%_{V_{N_2}}=100\%-40\%=60\%\)
c. Ta có: \(m_{NO}=0,1.30=3\left(g\right)\)
\(m_{N_2}=0,15.28=4,2\left(g\right)\)
=> \(\%_{m_{NO}}=\dfrac{3}{3+4,2}.100\%=41,7\%\)
\(\%_{m_{N_2}}=100\%-41,7\%=58,3\%\)