Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C.
N2+ 3H2 ⇌ 2NH3
Vì  nên hiệu suất tính theo H2
nên hiệu suất tính theo H2
N2+ 3H2 ⇌ 2NH3
Ban đầu 0,5 0,5 mol
Phản ứng x/3 x 2x/3 mol
Sau pứ 0,2 mol
Ở trạng thái cân bằng có 0,2 mol NH3 tạo thành nên 2x/3= 0,2
→x=0,3


Chọn B
Theo giả thiết ta thấy ban đầu H 2 = N 2 = 1 M .
Thực hiện phản ứng tổng hợp NH3 đến thời điểm cân bằng NH 3 = 0 , 4 M
Phương trình phản ứng hoá học :

Theo (1) tại thời điểm cân bằng [NH3] = 0,8M; [H2] =0,4M; [NH3] = 0,4M.
Vậy hằng số cân bằng của phản ứng tổng hợp NH3 là :
K C = NH 3 2 N 2 H 2 3 = ( 0 , 4 ) 2 0 , 8. ( 0 , 4 ) 3 = 3 , 125

Đáp án D.
N2+ 3H2 ⇌ 2NH3
Dựa vào công thức: PV=nRT
Ở nhiệt độ và thể tích không đổi (thể tích bình chứa luôn là 4 lít) và R là hằng số thì áp suất (P) tỉ lệ với số mol (n)
Theo đề áp suất sau bằng 9/10 áp suất ban đầu
→nkhí sau pứ= 9/10.nkhí ban đầu= 9/10. (8+16)= 21,6 mol
nNH3= nkhí trước pứ- nkhí sau pứ= (8+16)- 21,6= 2,4 mol


Đáp án B
Theo gải thiết ban đầu ta thấy [H2]=[N2]=1M
Thực hiện phản ứng tổng hợp NH3đến thời điểm cân bằng [NH3] = 0,4 m
Ta có: N2+3H2 ⇌2NH3
Bdau: 1………1………….0
p.ung:0,2…….0,6……….0,4
Sau: 0,8………0,4……….0,4
Tại thời điểm cân bằng [N2]=0,8;[H2]=0,4M;[NH3]=0,4M
→Kc = 3,125

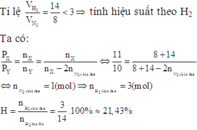
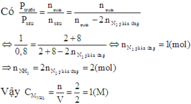
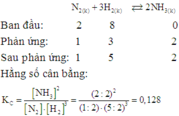
Đáp án A