Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Xét giai đoạn m gam Fe tác dụng với dung dịch H2SO4 loãng:
Sơ đồ phản ứng :
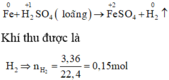
Các quá trình nhường, nhận electron :
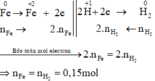
Xét giai đoạn m gam Fe tác dụng với H2SO4 đặc, nóng , dư:
Sơ đồ phản ứng:
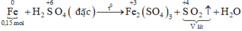
Các quá trình nhường, nhận electron:
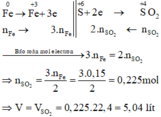

Đáp án C
![]()
Bảo toàn khối lượng: 3,22 + 0,06.98 = m + 0,06.2
m = 8,98 gam

\(n_{H_2}=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(0.15.................................0.15\)
\(n_{Fe}=1.25\cdot0.15=0.1875\left(mol\right)\)
\(2Fe+6H_2SO_{4\left(đ\right)}\rightarrow Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
\(0.1875..........................................0.28125\)
\(V_{SO_2}=6.3\left(l\right)\)

Đáp án D
Khí thu được là H2 : n H 2 = 13 , 44 22 , 4 = 0 , 6 mol
Gọi M là kim loại chung cho Mg, Fe và Zn với hóa trị n
Sơ đồ phản ứng :
![]()
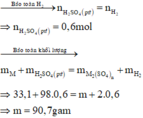

n H 2 = 1,344/22,4 = 0,06
n H 2 SO 4 = n H 2 = 0,060
n SO 4 2 - = n H 2 SO 4 = 0,06
m muối = m kim loại + m SO 4 2 - = 3,22 + 0,06 x 96 = 8,98g
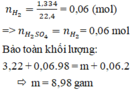
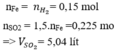

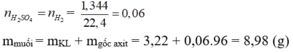
Câu 4 :
$n_{H_2SO_4} = n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)$
Bảo toàn khối lượng :
$m = 4,025 + 0,15.98 - 0,15.2 = 18,425(gam)$
Câu 5 :
$Fe + H_2SO_4 \to FeSO_4 + H_2$
$n_{Fe} = n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)$
$2Fe + 6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O$
$n_{SO_2} = \dfrac{3}{2}n_{Fe} = 0,225(mol)$
$V_{SO_2} = 0,225.22,4 = 5,04(lít)$
Câu 3: Theo gt ta có: $n_{SO_2}=0,125(mol);n_{NaOH}=0,2(mol)$
Gọi số mol $Na_2SO_3$ và $NaHSO_3$ lần lượt là a;b
Ta có: $a+b=0,125;2a+b=0,2$
Giải hệ ta được $a=0,075;b=0,05$
$\Rightarrow m_{muoi}=14,65(g)$
Câu 4: Theo gt ta có: $n_{H_2}=0,15(mol)$
Bảo toàn H ta có; $n_{H_2SO_4}=0,15(mol)$
$\Rightarrow m_{muoi}=m_{KL+m_{SO_4^{2-}}=18,425(g)$
Câu 5: Theo gt ta có: $n_{H_2}=n_{Fe}=0,15(mol)$
Bảo toàn e ta có: $n_{SO_2}=0,225(mol)\Rightarrow V_{SO_2}=5,04(l)$