
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



\(Cu\left(OH\right)_2+2HNO_3\rightarrow Cu\left(NO_3\right)_2+2H_2O\\ MgO+2HCl\rightarrow MgCl_2+H_2O\\ Fe\left(OH\right)_3+3HCl\rightarrow FeCl_3+3H_2O\\ Fe_2\left(SO_4\right)_3+3BaCl_2\rightarrow3BaSO_4\downarrow+2FeCl_3\)

nO2 = 5,6/22,4 = 0,25 (mol)
PTHH: 2KClO3 -> (t°, MnO2) 2KCl + 3O2
nKClO3 = 0,25 : 3 . 2 = 1/6 (mol)
nKClO3 = 1/6 . 122,5 = 245/12 (g)
nMg = 2,4/24 = 0,1 (mol)
PTHH: 2Mg + O2 -> (t°) 2MgO
LTL: 0,1/2 < 0,25 => O2 dư
nMgO = 0,1 (mol)
nMgO = 0,1 . 40 = 4 (g)
nO2 = 5,6 : 22,4 = 0,25(mol)
pthh : 2KClO3 -t--> 2KCl + 3O2
1/6 <----------------0,25(mol)
=>mKClO3 = 1/6.114,5=229/12(g)
nMg=2,4:24=0,1(mol)
pthh 2Mg+O2 -t-> 2MgO
0,1--------->0,1(mol)
=> mMgO = 0,1.40=4 (g)

Bài 2 : (1) liên kết ; (2) electron ; (3) liên kết ; (4) : electron ; (5) sắp xếp electron
Bài 4 :
$\dfrac{M_X}{4} = \dfrac{M_K}{3} \Rightarrow M_X = 52$
Vậy X là crom,KHHH : Cr
Bài 5 :
$M_X = 3,5M_O = 3,5.16 = 56$ đvC
Tên : Sắt
KHHH : Fe
Bài 9 :
$M_Z = \dfrac{5,312.10^{-23}}{1,66.10^{-24}} = 32(đvC)$
Vậy Z là lưu huỳnh, KHHH : S
Bài 10 :
a) $PTK = 22M_{H_2} = 22.2 = 44(đvC)$
b) $M_{hợp\ chất} = X + 16.2 = 44 \Rightarrow X = 12$
Vậy X là cacbon, KHHH : C
Bài 11 :
a) $PTK = 32.5 = 160(đvC)$
b) $M_{hợp\ chất} = 2A + 16.3 = 160 \Rightarrow A = 56$
Vậy A là sắt
c) $\%Fe = \dfrac{56.2}{160}.100\% = 70\%$

Gọi hóa trị của N,C,K trong 3 hợp chất trên lần lượt là a,b,c
Ta có \(\left\{{}\begin{matrix}N_1^aH_3^I\Rightarrow a=I\cdot3=3\Rightarrow N\left(III\right)\\C_1^bH_4^I\Rightarrow b=4\cdot I=4\Rightarrow C\left(IV\right)\\K_2^cO_1^{II}\Rightarrow2c=II\cdot1\Rightarrow c=1\Rightarrow K\left(I\right)\end{matrix}\right.\)


Câu 5 :
\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
a) Pt : \(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
0,2 0,4 0,2
\(n_{HCl}=\dfrac{0,2.2}{1}=0,4\left(mol\right)\)
\(V_{ddHCl}=\dfrac{0,4}{2}=0,2\left(l\right)\)
b) \(n_{H2}=\dfrac{0,4.1}{2}=0,2\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,2.22,4=4,48\left(l\right)\)
c) \(n_{CuO}=\dfrac{8}{80}=0,1\left(mol\right)\)
Pt : \(H_2+CuO\rightarrow\left(t_o\right)Cu+H_2O|\)
1 1 1 1
0,2 0,1 0,1
Lập tỉ số so sánh : \(\dfrac{0,2}{1}>\dfrac{0,1}{1}\)
⇒ H2 dư , CuO phản ứng hết
⇒ Tính toán dựa vào số mol của CuO
\(n_{H2O}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
⇒ \(m_{H2O}=0,1.18=1,8\left(g\right)\)
Chúc bạn học tốt


nMg = 4,8: 24=0,2 (mol)
PTHH : Mg +2HCl---> MgCL2 + H2 (1)
0,2------------------------>0,2(mol)
VH2= 0,2.22,4=4,48(l)
c) pthh : 2H2+ O2 --> 2H2O
0,2-----------> 0,2 (mol)
mH2O = 0,2. 18 = 3,6 (g)
nMg = 4,8/24 = 0,2 (mol)
PTHH: Mg + 2HCl -> MgCl2 + H2
Mol: 0,2 ---> 0,2 ---> 0,2 ---> 0,2
VH2 = 0,2 . 22,4 = 4,48 (l)
nO2 = 4,48/22,4 = 0,2 (mol)
PTHH: 2H2 + O2 -> (t°) 2H2O
LTL: 0,2/2 < 0,2 => O2 dư
nH2O = 0,2 (mol)
mH2O = 0,2 . 18 = 3,6 (g)
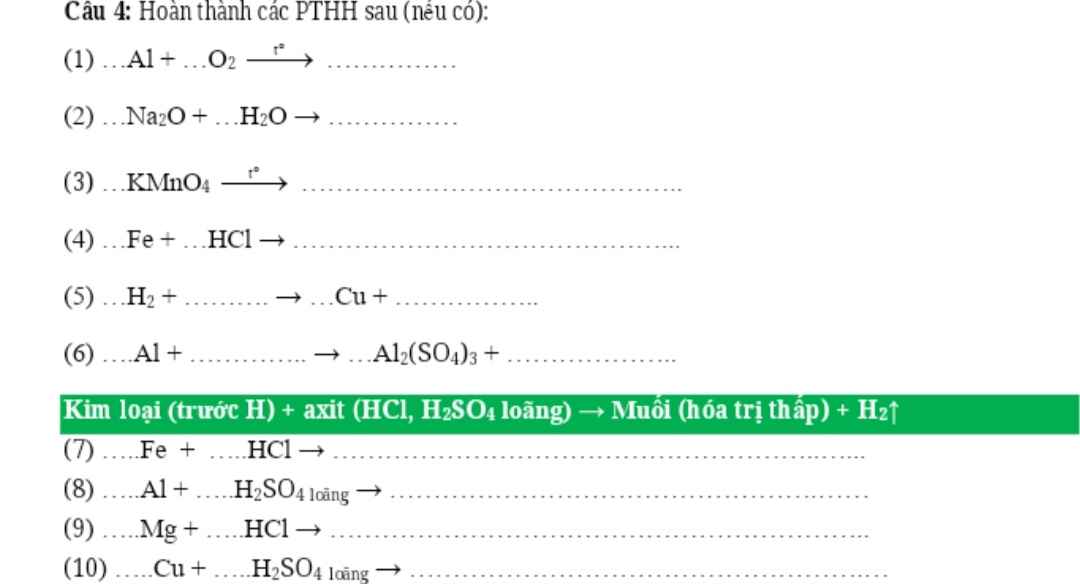

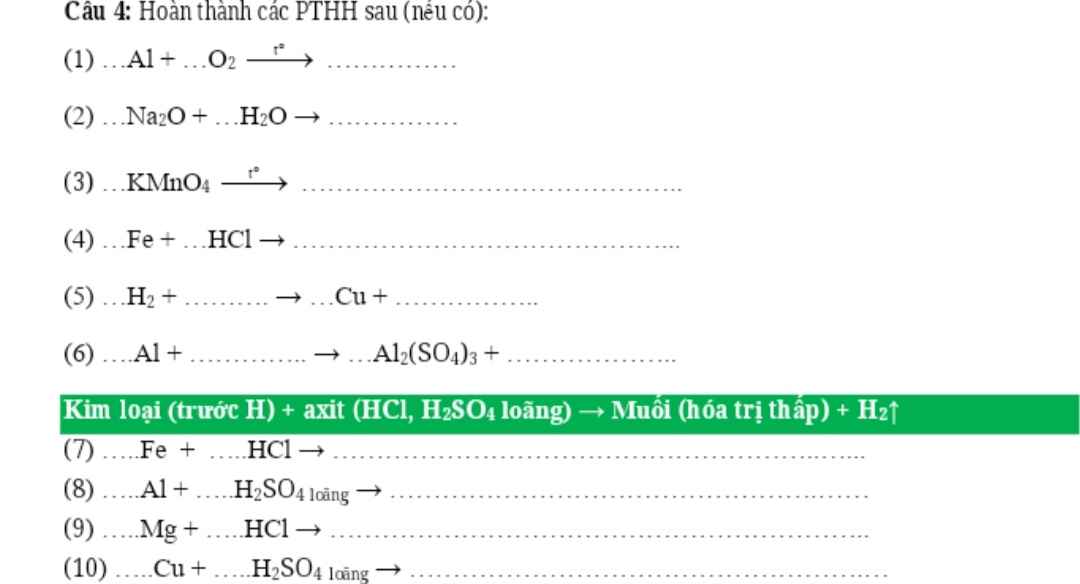








4Al + 3O2 ---> 2Al2O3
Na2O + H2O ---> 2NaOH
2KMnO4 ---> K2MnO4 + MnO2 + O2
Fe + 2HCl ---> FeCl2 + H2
H2 + CuO ---> Cu + H2O
2Al + 3H2SO4 ---> Al2(SO4)3 + 3H2