
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Bài 3:
a. Nồng độ phần trăm của dd thu được là:
\(C\%=\dfrac{m_{ct}}{m_{dd}}.100\%=\dfrac{20}{20+180}.100=10\left(\%\right)\)
b. Số mol K2O: \(n_{K_2O}=\dfrac{9,4}{94}=0,1\left(mol\right)\)
\(PTHH:K_2O+H_2O\rightarrow2KOH\)
(mol)_____0,1___________0,2__
Nồng độ mol dd thu được là:
\(C_M=\dfrac{n}{V}=\dfrac{0,2}{0,2}=1\left(M\right)\)

a) $2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2$
b)
n H2 = 6,72/22,4 = 0,3(mol)
n Al = 2/3 n H2 = 0,2(mol)
m Al = 0,2.27 = 5,4(gam)
m Cu = 10 - 5,4 = 4,6(gam)
c) n H2SO4 = n H2 = 0,3(mol)
m dd H2SO4 = 0,3.98/20% = 147 gam


\(MgCl_2+2KOH\rightarrow Mg\left(OH\right)_2+2KCl\)
\(Cu\left(OH\right)_2+2HCl\rightarrow CuCl_2+2H_2O\)
1) MgCl2 + 2KOH → Mg(OH)2 + 2KCl
2) Cu(OH)2 + 2HCl → CuCl2 + 2H2O

a)
ta có \(n_{N_2}=\dfrac{4,2}{28}=0,15\left(mol\right)\)
\(\Rightarrow V_{N_2}=0,15.22,4=3,36l\)
ta có \(n_{O_2}=\dfrac{3,2}{32}=0,1\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,1.22,4=2,24l\)
b)
ta có \(n_{SO_2}=\dfrac{32}{64}=0,5\left(mol\right)\)
\(\Rightarrow V_{SO_2}=0,5.22,4=11,2l\)
ta có \(n_{O_2}=\dfrac{32}{32}=1\left(mol\right)\)
\(\Rightarrow V_{O2}=1.22,4=22,4l\)
c)
ta có \(n_{H_2}=\dfrac{2}{2}=1\left(mol\right)\)
\(\Rightarrow V_{H_2}=1.22,4=22,4l\)
ta có \(n_{O_2}=\dfrac{8}{32}=0,25\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,25.22,4=5,6l\)
d)
ta có \(n_{N_2}=\dfrac{8,4}{28}=0,3\left(mol\right)\)
\(\Rightarrow V_{N_2}=0,3.22,4=6,72l\)
ta có \(n_{O_2}=\dfrac{6,4}{32}=0,2\left(mol\right)\)
\(\Rightarrow V_{N_2}=0,2.22,4=4,48l\)


PTHH: \(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
Ta có: \(n_{H_2SO_4\left(dư\right)}=\dfrac{1}{2}n_{NaOH}=\dfrac{0,1\cdot1}{2}=0,05\left(mol\right)\)
\(\Rightarrow n_{H_2SO_4\left(p.ứ\right)}=0,3\cdot2-0,05=0,55\left(mol\right)\)
PTHH: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
a________\(\dfrac{3}{2}\)a (mol)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
b_______b (mol)
Ta lập hệ phương trình: \(\left\{{}\begin{matrix}27a+56b=16,6\\\dfrac{3}{2}a+b=0,55\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=\dfrac{71}{285}\\b=\dfrac{67}{380}\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{\dfrac{71}{285}\cdot27}{16,6}\cdot100\%\approx40,52\%\\\%m_{Fe}=59,48\%\end{matrix}\right.\)

\(a,PTHH:2Al+6HCl\to 2AlCl_3+3H_2\\ b,n_{Al}=\dfrac{5,4}{27}=0,2(mol)\\ \Rightarrow n_{H_2}=\dfrac{3}{2}n_{Al}=0,3(mol)\\ \Rightarrow V_{H_2}=0,3.22,4=6,72(l)\\ c,n_{AlCl_3}=n_{Al}=0,2(mol)\\ \Rightarrow m_{AlCl_3}=0,2.133,5=26,7(g)\)



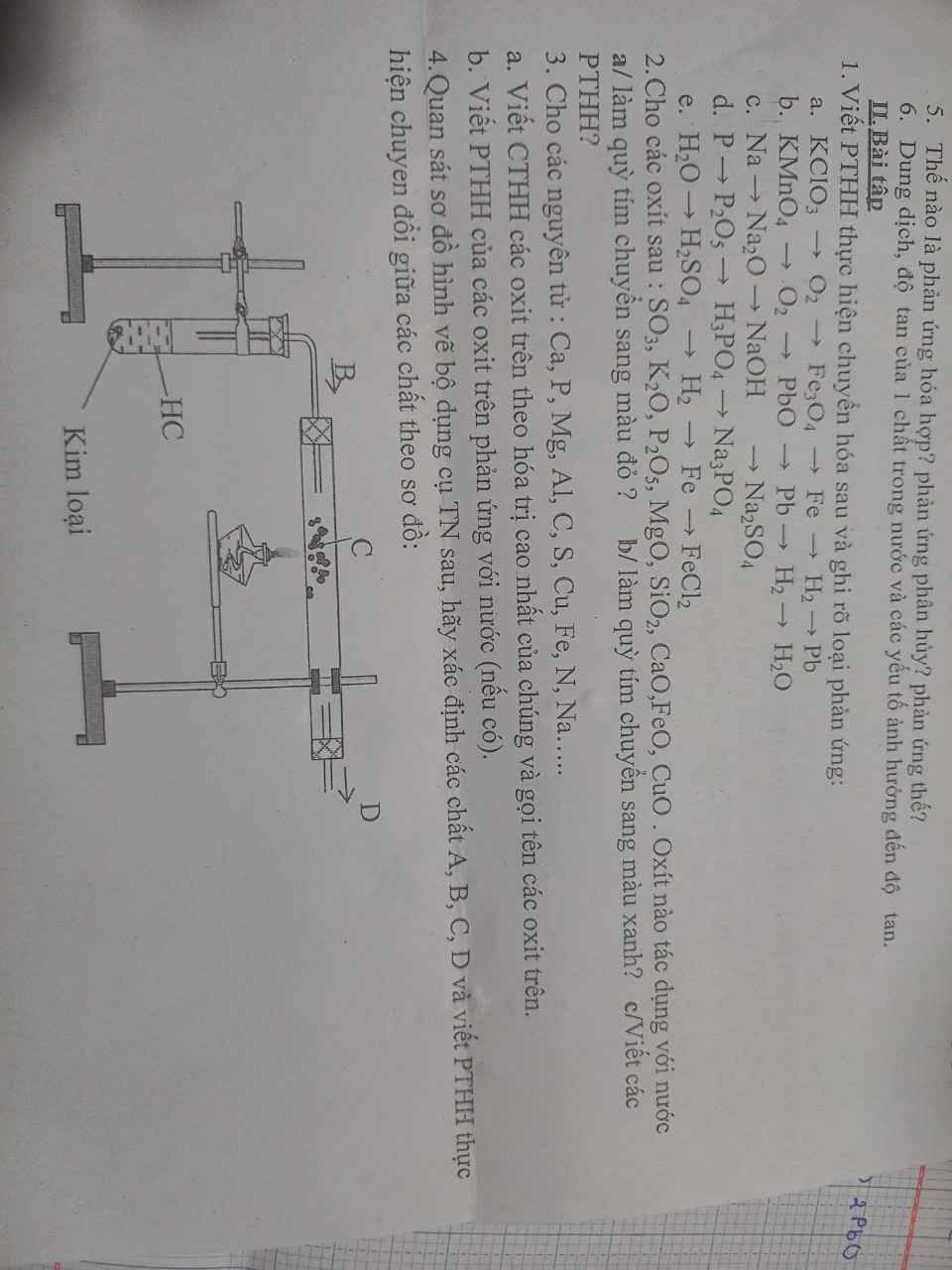 mn giải giúp em với ạ em đag cần gấp , em cảm ơn
mn giải giúp em với ạ em đag cần gấp , em cảm ơn



