Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Fe}=\dfrac{2,8}{56}=0,05mol\)
\(n_{Al}=\dfrac{0,81}{27}=0,03mol\)
\(B:8,12g\left\{{}\begin{matrix}Cu:a\left(mol\right)\\Ag:b\left(mol\right)\\Fe:c\left(mol\right)\end{matrix}\right.\Rightarrow64a+108b+56c=8,12\)(*)
\(n_{H_2}=\dfrac{0,672}{22,4}=0,03mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
0,03 0,03
\(\Rightarrow c=n_{Fe}=0,03mol\)
Thay vào (*) ta được: \(64a+108b=8,12-0,03\cdot56\left(1\right)\)
\(n_{Fepư}=0,05-0,03=0,02mol\)
\(BTe:2n_{Cu}+n_{Ag}=3n_{Fepư}+2n_{H_2}\)
\(\Rightarrow2a+b=2\cdot0,02+3\cdot0,03\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,05\\b=0,03\end{matrix}\right.\)
\(C_{M_{Cu\left(NO_3\right)_2}}=\dfrac{0,05}{0,1}=0,5M\)
\(C_{M_{AgNO_3}}=\dfrac{0,03}{0,1}=0,3M\)

Đáp án B.
Al là kim loại hoạt động hoá học mạnh hơn Fe nên Al phản ứng hết trước. Trường hợp 1 : Al vừa đủ phản ứng, còn Fe không phản ứng và kim loại Ag, Cu được giải phóng.
Al + 3 AgNO 3 → Al NO 3 3 + 3Ag
2Al + 3 Cu NO 3 2 → 2 Al NO 3 3 + 3Cu
Trường hợp 2 : Al phản ứng hết, sau đó đến Fe phản ứng, Fe dư và kim loại Ag, Cu được giải phóng.
Fe + 2 AgNO 3 → Fe NO 3 2 + 2Ag
Fe + Cu NO 3 2 → Fe NO 3 2 + Cu
Chất rắn D gồm Ag, Cu và Fe.

T gồm : $Cu(x\ mol) ; Ag(2x\ mol) ; Fe$ dư(y mol)
Suy ra: $64x + 108.2x + 56y = 61,6(1)$
$n_{Fe\ pư} = a - y(mol)$
Bảo toàn electron :
$(a- y).2 + 0,25.2 = 2x + 2x(2)$
$2x + 2x + 3y = 0,55.2(3)$
Từ (1)(2)(3) suy ra a = 0,25 ; x = 0,2 ; y = 0,1
T gồm 3 kim loại là Cu (x), Ag (2x) và Fe dư (y)
\(m_T=64x+108\cdot2x+56y=61.6\left(g\right)\left(1\right)\)
Bảo toàn e :
\(2x+2x+3y=0.55\cdot2\left(2\right)\)
\(\left(1\right),\left(2\right):x=0.2,y=0.1\)
Bảo toàn electron:
\(2\cdot\left(a-0.1\right)+0.25\cdot2=2\cdot0.2+0.2\cdot2\)
\(\Rightarrow a=0.25\)

Chất rắn chứa 3 kim loại nên Fe dư
\(Al+3AgNO_3\rightarrow Al\left(NO_3\right)_3+3Ag\)
x/3_____ x_____________________
\(2Al+3Cu\left(NO_3\right)_2\rightarrow2Al\left(NO_3\right)_3+3Cu\)
\(\frac{0,03-x}{3}\rightarrow0,0045-0,5x\)
\(Fe+Cu\left(NO_3\right)_2\rightarrow Fe\left(NO_3\right)_2+Cu\)
1,5x-0,045__1,5x-0,045 __Fe còn dư = 0,095-1,5x
Ta có :
\(m_{kl}=x.108+\left(0,045-0,5x\right).64+\left(0,095-1,5x\right).56=8,12\)
\(\rightarrow x=0,01\)
\(\rightarrow CM=0,1M\)

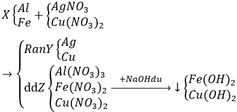
Pt:
Al + 3AgNO3 → Al(NO3)3 + 3Ag↓
2Al + 3Cu(NO3)2 → 2Al(NO3)2 + 3Cu↓
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag↓
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu↓
Al(NO3)3 + 3NaOH → Al(OH)3↓ + 3NaNO3
Al(OH)3 + NaOH → NaAlO2 + 2H2O
Fe(NO3)2 + 2NaOH → Fe(OH)2↓ + 2NaNO3
Cu(NO3)2 + 2NaOH → Cu(OH)2↓ + 2NaNO3
Ta có: \(n_{Fe}=\dfrac{2,8}{56}=0,05\left(mol\right)\)
\(n_{Al}=\dfrac{0,81}{27}=0,03\left(mol\right)\)
- E gồm: Ag, Cu và Fe dư.
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(n_{Fe\left(dư\right)}=n_{H_2}=\dfrac{0,672}{22,4}=0,03\left(mol\right)\) ⇒ nFe pư = 0,05 - 0,03 = 0,02 (mol)
⇒ mAg + mCu = 8,12 - 0,03.56 = 6,44 (g)
Gọi: \(\left\{{}\begin{matrix}n_{AgNO_3}=x\left(mol\right)\\n_{Cu\left(NO_3\right)_2}=y\left(mol\right)\end{matrix}\right.\)
BTNT Ag: nAg = nAgNO3 = x (mol)
BTNT Cu: nCu = nCu(NO3)2 = y (mol)
⇒ 108x + 64y = 6,44 (1)
Theo ĐLBT e, có: 2nFe pư + 3nAl = nAg+ + 2nCu2+ ⇒ nAg + 2nCu = 0,13 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,03\left(mol\right)\\y=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{AgNO_3}}=\dfrac{0,03}{0,2}=0,15\left(M\right)\\C_{M_{Cu\left(NO_3\right)_2}}=\dfrac{0,05}{0,2}=0,25\left(M\right)\end{matrix}\right.\)