Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Coi \(n_{O_2} =n_{SO_2} = 1(mol)\)
\(n_{SO_2\ pư} = 1.60\% = 0,6(mol)\)
2SO2 + O2 \(\xrightarrow{t^o,xt}\) 2SO3
0,6...........0,3............0,6
Khí tạo thành gồm :
SO2 : 1-0,6 = 0,4(mol)
O2 : 1-0,3 =0,7(mol)
SO3 : 0,6(mol)
Vậy :
\(\%V_{SO_2} = \dfrac{0,4}{0,4 +0,7 + 0,6}.100\% = 23,53\%\\ \%V_{O_2} = \dfrac{0,7}{0,4 + 0,7 + 0,6}.100\% = 41,18\%\\ \%V_{SO_3} = 100\% -23,53\%-41,18\% = 35,29\%\)

Giả sử các khí đo ở điều kiện sao cho 1 mol khi có thể tích V lít
\(n_{CO}+n_{CO_2}=\dfrac{20}{V}\)
\(n_{O_2}=\dfrac{8}{V}\left(mol\right)\)
PTHH: 2CO + O2 --to--> 2CO2
_____\(\dfrac{16}{V}\)<---\(\dfrac{8}{V}\)
=> \(\left\{{}\begin{matrix}n_{CO}=\dfrac{16}{V}\\n_{CO_2}=\dfrac{20}{V}-\dfrac{16}{V}=\dfrac{4}{V}\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}\%V_{CO}=\dfrac{\dfrac{16}{V}}{\dfrac{20}{V}}.100\%=80\%\\\%V_{CO_2}=\dfrac{\dfrac{4}{V}}{\dfrac{20}{V}}.100\%=20\%\end{matrix}\right.\)

Chọn 1 mol hỗn hợp Y =>số mol N2 = 0,848 mol; số mol O2 ban đầu = 0,212 mol
=>số mol O2 phản ứng = 0,212 – 0,012 = 0,2 mol
2FeS + 3,5O2 → Fe2O3 + 2SO2
a→ 1,75a→ a
2FeS2 + 5,5O2 → Fe2O3 + 4SO2
b → 2,75b → 2b
=>1,75a+2,75b = 0,2
a+2b= 0,14
=>a=0,02; b=0,06
%khối lượng FeS = 0,02.88\0,02.88+0,06.120.100% = 19,64%

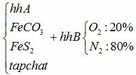
a) Gọi số mol của FeCO3: x (mol) ;
số mol của FeS2: y (mol)
4FeCO3 + O2 → Fe2O3 + 4CO2↑
x → 0,25x → x (mol)
4FeS2 +11O2 → 2Fe2O3 + 8SO2↑
y → 2,75y → 2y (mol)
∑ nO2 = 0,25x + 2,75y (mol)
Cùng điều kiện về nhiệt độ và áp suất nên tỉ lệ về thể tích = tỉ lệ về số mol
=> nN2 = 4nO2 = 4(0,25x + 2,75y)
=> nN2 = x + 11y (mol)
Vậy hỗn hợp Y gồm:
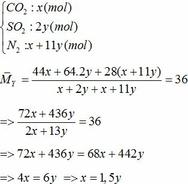
Khối lượng Fe có trong Z là:
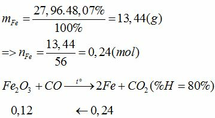
Vì H = 80% => nFe2O3 (trong X) = 0,12. 100% : 80% = 0,15 (mol)
nFe2O3 dư (trong Z) = 0,15 – 0,12 = 0,03 (mol)
Khối lượng tạp chất trong Z = 27,96 – mFe – mFe2O3 dư = 27,96 – 0,24.56 – 0,03.160 = 9,72 (g)
Bảo toàn nguyên tố Fe => nFeCO3 + nFeS2 = 2nFe2O3(trong X)
=> x + y = 0,3 (2)
Từ (1) và (2) => x = 0,18 và y = 0,12 (mol)
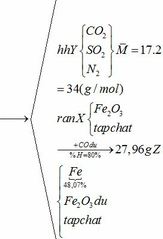
Áp dụng công thức PV = nRT ( với n = nCO2 + nSO2 + nN2 = 0,18 + 2. 0,12 + 0,18 +11.0,12 = 1,92)
=> P.10 = 1,92.0,082. (136,5 +273)
=> P = 6,447 ( atm) ≈ 6,5 (atm)
Ta có: mA = mFeCO3 + mFeS2 + mtạp chất = 0,18.116 + 0,12.120 + 9,72 = 45 (g)
![]()
b) hỗn hợp Y gồm:
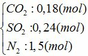
Cho hỗn hợp Y qua O2 ( xúc tác V2O5 ) có phản ứng sau:
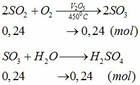
Khối lượng dd sau: mdd sau = mSO3 + mH2O = 0,24. 80 + 592,8 = 612 (g)
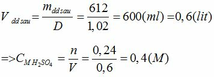

- Nhiệt độ sôi của các chất:
trong dầu nhờn > trong dầu hoả > trong xăng.
- Khả năng bay hơi của các chất :
trong xăng > trong dầu hoả > trong dầu nhờn.
- Phân tử khối của các chất:
trong dầu nhờn > trong dầu hoả > trong xăng.

\(28ml=0,028l\)
\(67,2ml=0,0672l\)
Giả sử ta đo ở đktc
Gọi \(\left\{{}\begin{matrix}n_{CH_4}=x\\n_{C_2H_2}=y\end{matrix}\right.\)
\(n_{hh}=\dfrac{0,028}{22,4}=0,00125mol\)
\(n_{O_2}=\dfrac{0,0672}{22,4}=0,003mol\)
\(CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\)
x 2x ( mol )
\(2C_2H_2+5O_2\rightarrow\left(t^o\right)4CO_2+2H_2O\)
y 5/2 y ( mol )
Ta có:
\(\left\{{}\begin{matrix}x+y=0,00125\\2x+\dfrac{5}{2}y=0,003\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=0,00025\\y=0,001\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,00025}{0,00125}.100=20\%\\\%V_{C_2H_2}=100\%-20\%=80\%\end{matrix}\right.\)
=> Chọn A

X, Y điều chế bằng chưng cất phân đoạn không khí → X, Y là O2 và N2
Chất Z làm CuSO4 khan chuyển màu xanh → Z: H2O
Pt: NH4N(NO2)2 → O2 + 2N2 + 2H2O
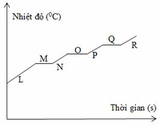

Ta thấy nhiệt độ sôi của oxi thấp nhất (-1830C) , sau đó đến argon (- 1860C ) và cuối cùng là nitơ (-1960C) => khi nâng dần nhiệt độ từ thấp nên cao ta sẽ thu được oxi trước => đến argon rồi đến nitơ
Nhiệt độ sôi của các chất là cố định, nên đoạn nằm ngang ( không biến thiên) chính là hằng số nhiệt độ sôi của các chất => đoạn MN là nhiệt độ sôi của oxi, đoạn OP là nhiệt độ sôi của Argon, đoạn OR là nhiệt độ sôi của nitơ.