Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(\overline{Fe}=\dfrac{5,84.55+56.91,68+57.2,17+58.0,31}{100}=55,9695\)
%56Fe trong oxit sắt từ Fe3O4 là
\(\%^{56}Fe=\dfrac{56.3.91,68\%}{55,9695.3+16.4}.100=65,42\%\)

Đáp án C
Gọi phần trăm khối lượng của đồng vị 55Fe, 56Fe lần lượt là x, y
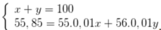
=>

Đáp án A
• Khối lượng nguyên tử trung bình của Fe là
MFe = 0,058 x 54 + 0,9172 x 56 + 0,022 x 57 + 0,0028 x 58 = 55,9116.
Khối lượng trung bình của Br là
MBr = 0,5069 x 79 + 0,4931 x 81 = 79,9862.
Phần trăm khối lượng của 56Fe trong FeBr3 là
![]()

Chọn A
Thể tích của 1 mol Fe là: 55 , 847 : 7 , 87 = 7 , 096 c m 3
Thể tích của một nguyên tử Fe là:
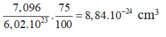
Bán kính gần đúng của nguyên tử Fe là:
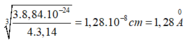

1 kg Fe có số mol là : 1000/56 = 125/7 (mol )
1 mol Fe có : 6,02 . 10^23 nguyên tử Fe
=> số nguyên tử Fe có trong 1kg Fe là :
125/7 . 6,02 . 10^23 = 1,075 . 10^25 nguyên tử
Mà 1 nguyên tử Fe có 26e
=> số e có trong 1kg Fe
26 . 1,075 . 10^25 = 2, 795 . 10^26
mà 1 e nặng 9,1 . 10^(-31) kg
khối lượng e có trong 1kg Fe là :
2,795 . 10^26 . 9,1 . 10^(-31) = 2.54345 . 10^(-4)
= 2,54345 . 10^(-1) =0,254345.
__1 kg Fe chứa 2.54345*10^(-4) kg eletron
x kg Fe chứa 1 kg eletron
==> x= 1*1/2.54345*10^(-4)= 3931.67 kg Fe

Bài 7:
\(n_{Fe}=\dfrac{1000}{55,85}\left(mol\right)\)
Trong 1 kg sắt thì khối lượng electron là:
\(m_e=\dfrac{1000}{55,85}.26.9,1094.10^{-28}\approx4240,723.10^{-28}\left(g\right)\approx4240,723.10^{-31}\left(kg\right)\)
Bài 8:
\(m_{Ne}=20,179.0,16605.10^{-23}=3,35072295.10^{-23}\left(g\right)\)
a, mFe2(SO4)3= 55,97.2+ 3. (32+ 16.4) = 399,94 (g/mol )
=> tỉ lệ đồng vị của56Fe chứa trong muối sắt (III) sunfat Fe2(SO4)3 là
\(\dfrac{56.91,68}{399,94}\) . 100% = 12. 83%
b. mFe(OH)2= 55,97 + 2. (16+1) = 89,97 (g/ mol)
=> tỉ lệ đồng vị của 55Fe chứa trong muối sắt (II) hidroxit Fe(OH)2 là
\(\dfrac{55.5,84}{89,97}\) .100% = 3,57%
Giúp mình với ạ ! Ghi cụ thể hộ mình luôn nhea ! Thân !