Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
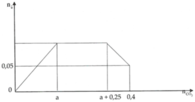
nCaCO3 max = nCa(OH)2 = b = 0,5 mol
nCO2 max = nNaHCO3 + 2nCa(HCO3)2
=> nNaHCO3 = nNaOH = a = 0,4 mol
=> a : b = 0,4 : 0,5 = 4 : 5

Đáp án D
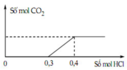
nOH- = a+b; nCO32- = c
Từ lúc bắt đầu nhỏ HCl đến lúc bắt đầu xuất hiện khí:
H+ + OH- → H2O
a+b←a+b
H+ + CO32- → HCO3-
c ← c → c
=> nHCl = a+b+c = 0,3 (1)
Lúc xuất hiện khí:
H+ + HCO3- → CO2 + H2O
c c
=> nHCl = a+b+c+c = 0,4 (2)
(1) và (2) => a+b= 0,2

Đáp án A
nOH- = 0,1.2 + 0,225 + 0,2 = 0,625 mol
Do nH+>nCO2 nên X có cả CO32- => X không có Ba2+ => nBaCO3 = 0,1 mol
Đặt x, y là số mol CO32- và số mol HCO3- phản ứng với H+
x+y = nCO2 = 0,25
2x+y = nH+ = 0,35
=> x = 0,1; y = 0,15
Dung dịch X chứa: K+ (0,225 mol), Na+ (0,2 mol), CO32- (0,1k mol), HCO3- (0,15k mol)
BTĐT: 0,225 + 0,2 = 2.0,1k + 0,15k => k = 1,3
BTNT C: nCO2 ban đầu = nBaCO3 + nCO32- + nHCO3- = 0,1 + 0,13 + 0,195 = 0,425 mol
=> V = 9,52 lít

Đáp án B.
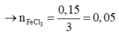
![]()
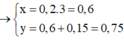
=> x:y = 4:5
CH2=CH-C≡CH + H2 → Pd , PbCO 3 H 2 , t o CH2=CH-CH=CH2
nCH2=CH-CH=CH2 + nCH2=CH-CN → xt , p t o (-CH2-CH=CH-CH2-CH2-CH(CN)-)n.

Đáp án A
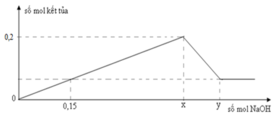
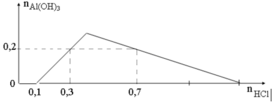
Từ đồ thị ta thấy số mol HCl bắt đầu 0,1 mol mới xuất hiện kết tủa
=> 0,1 mol HCl dùng để trung hòa Ba(OH)2
=> nOH- = nH+ = 0,1 (mol) => nBa(OH)2 = 1/2nOH- = 0,05 (mol) = a
Ta thấy tại giá trị nHCl = 0,3 và 0, 7 mol đều thu được lượng kết tủa như nhau Al(OH)3: 0,2 (mol)
=> Tại nHCl = 0,7 mol thì lượng kết tủa Al(OH) đã đạt cực đại, sau đó bị hòa tan đến khi còn 0, 2 mol
Áp dung công thức nhanh ta có:
nH+ = 4nAlO2 – 3nAl(OH)3 + nOH-
=>0, 7 = 4. 2b – 3. 0,2 + 0,1
=> b = 0,15 (mol)
Vậy a: b = 0,05: 0,15 = 1: 3

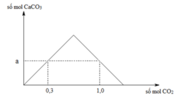
Ta có giá trị a = 0,3 mol.
Tại thời điểm nCO2 = 1 mol trong dung dịch vẫn có nCaCO3 = 0,3 mol.
⇒ Bảo toàn C ⇒ nCa(HCO3)2 = (1 – 0,3) ÷ 2 = 0,35 mol.
⇒ ∑nCa(OH)2 = 0,3 + 0,35 = 0,75 mol.
+ Nếu sục 0,85 mol CO2 vào 0,75 mol Ca(OH)2.
⇒ nCaCO3 = ∑n(OH–) – nCO2 = 0,75 × 2 – 0,85 = 0,45 mol.
⇒ mCaCO3 = 0,45 × 100 = 45 gam
Đáp án C

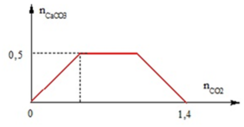
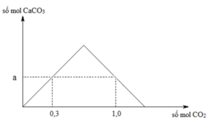
Ta có giá trị a = 0,3 mol.
Tại thời điểm nCO2 = 1 mol trong dung dịch vẫn có nCaCO3 = 0,3 mol.
⇒ Bảo toàn C ⇒ nCa(HCO3)2 = (1 – 0,3) ÷ 2 = 0,35 mol.
⇒ ∑nCa(OH)2 = 0,3 + 0,35 = 0,75 mol.
+ Nếu sục 0,85 mol CO2 vào 0,75 mol Ca(OH)2.
⇒ nCaCO3 = ∑n(OH–) – nCO2 = 0,75 × 2 – 0,85 = 0,45 mol.
⇒ mCaCO3 = 0,45 × 100 = 45 gam
Đáp án C
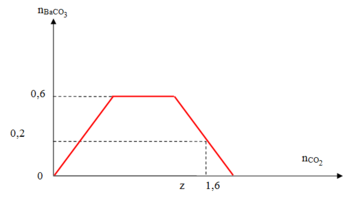


Đáp án B
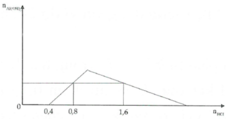
Quá trình đầu tiên là phản ứng: Ba(OH)2 + CO2 → BaCO3↓ + H2O
Đến khi Ba(OH)2 hết, kết tủa là cực đại ⇒ y = nBa(OH)2 = 0,6 mol.
Sau đó là quá trình: NaOH + CO2 → NaHCO3 || KOH + CO2 → KHCO3.
Kết tủa không thay đổi, sau đó: CO2 + BaCO3 → Ba(HCO3)2
Kết tủa bị hòa tan cho đến hết 1,6 mol = ∑nCO2 = nNaOH + nKOH + 2nBa(OH)2
⇒ x = 1,6 – 0,1 – 0,6 × 2 = 0,3 mol.
Xét tại điểm z, đang xảy ra quá trình hòa tan BaCO3,
NẾU thêm 0,2 mol CO2 nữa sẽ hòa tan hết BaCO3
⇒ x + 0,2 = 1,6 mol → z = 1,4 mol. Vậy x = 0,3; x = 0,6 và z = 1,4