Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(a.Al,Ag+H_2SO_4\rightarrow ChỉcóAlphảnứng,chấtrắnsauphảnứnglàAg\\ n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ 2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ TheoPT:n_{Al}=\dfrac{2}{3}n_{H_2}=0,1\left(mol\right)\\ \Rightarrow m_{Al}=0,1.27=2,7\left(g\right)\\ \Rightarrow m_{rắnsaupu}=m_{Ag}=15,4-2,7=12,7\left(g\right)\\ b.\%m_{Al}=\dfrac{2,7}{15,4}.100=17,53\%,\%m_{Ag}=100-17,53=82,47\%\)

Gọi số mol FeCO3, ZnCO3 là a, b (mol)
PTHH: FeCO3 --to--> FeO + CO2
a----------->a
ZnCO3 --to--> ZnO + CO2
b--------->b
mbđ = 116a + 125b (g)
msau pư = 72a + 81b (g)
=> \(\dfrac{72a+81b}{116a+125b}=\dfrac{6,21}{9,73}\)
=> 19,8a = 11,88b
=> a = 0,6b
\(\%m_{FeCO_3}=\dfrac{116a}{116a+125b}.100\%=\dfrac{116.0,6b}{116.0,6b+125b}.100\%=35,766\%\)
=> \(\%m_{ZnCO_3}=100\%-35,766\%=64,234\%\)
Với các bài tập chỉ có tỉ lệ và phần trăm, có thể đặt một lượng chất bất kì. Đối với bài này, đặt khối lượng chất rắn thu được là 6,21 gam, khối lượng muối ban đầu là 9,73 gam
FeCO3 → FeO + CO2 ZnCO3 → ZnO + CO2
a a b b mol
mFeCO3 + mZnCO3 = 116a + 125b = 9,73 gam
mFeO + mZnO = 72 + 81b = 6,21 gam
a = 0,03 mol; b = 0,05 mol

a. Các phương trình có thể xảy ra:
C + O2 → t ∘ CO2 (1)
CaCO3 → t ∘ CaO + CO2 (2)
MgCO3 → t ∘ MgO + CO2 (3)
CuCO3 → t ∘ CuO + CO2 (4)
C +CO2 → t ∘ 2CO (5)
C + 2CuO → t ∘ 2Cu + CO2 (6)
CO + CuO → t ∘ Cu + CO2 (7)
CaO + 2HCl →CaCl2 + H2O (8)
MgO + 2HCl →MgCl2 + H2O (9)
CuO + 2HCl →CuCl2 + H2O (10)
b. Vì sau phản ứng có CO và CO2, các phản ứng xảy ra hoàn toàn nên các chất còn lại sau khi nung là CaO, MgO và Cu không có phản ứng (10)
mCu = 3,2(g) => mCuCO3 = 6,2g
Gọi số mol CaCO3, MgCO3, C trong hỗn hợp lần lượt là a, b, c.(*)
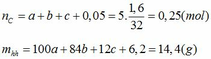
Giải ( *), (**), (***) ta được a=0,025; b=0,05; c=0,125.
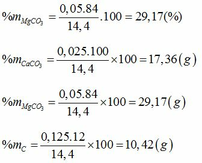

Giả sử hỗn hợp ban đầu có khối lượng là 100g
CaCO3 ---to ----> CaO + CO2
Khối lượng sau =78% khối lượng hỗn hợp ban đầu
=> \(m_{sau}=100.78\%=78\left(g\right)\)
=> \(m_{giảm}=m_{CO_2}=22\left(g\right)\)
=> \(n_{CO_2}=0,5\left(mol\right)\)
Ta có : \(n_{CaCO_3}=n_{CO_2}=0,5\left(mol\right)\)
=> \(\%m_{CaCO_3}=\dfrac{0,5.100}{100}.100=50\%\)
=> %mNaCl = 50%

nAgNO3 = 1.5*0.3=0.45(mol)
vì cho 2.3 g Mg vào A thấy có rắn C => AgNO3 dư
nMg(pư 4) =(2.4-1.92)/24=0.02(mol)
KCl + AgNO3 --> KNO3 + AgCl
a................a
MgCl2 + 2AgNO3 ---> Mg(NO3)2 + 2AgCl
0.08----------0.16-------( 0.1-0.02)
NaCl + AgNO3 ---> NaNO3 + AgCl
b...............b
Mg + 2AgNO3 ----> Mg(NO3)2 +2 Ag (4)
0.02---------0.04 ------------ 0.02
dd D gồm NaNO3,KNO3 và Mg(NO3)2
NaOH + Mg(NO3)2---> Mg(OH)2 +NaNO3
-------------- 0.1 ------------ 0.1
nMgO= 4/40 =0.1(mol)
Mg(OH)2 ----->MgO + H2O
0.1 --------------0.1
NAgNO3 =0.45 = 0.04 +a+b+0.16
=> a+b=0.25(mol)
mMgCl2=0.08*95=7.6 g
Ta có hệ
a+b=0.25
74.5*a + 58.5*b=24.625-7.6
=> a=0.15 , b=0.1
%KCl =(74.5*0.15*100)/24.625=45.4%
%NaCl=(58.5*0.1*100)/24.625=23.8%
%MgCl2=100%-45.4%-23.8% =30.8%
Gọi số mol C a C O 3 và M g C O 3 lần lượt là a và b mol
→ 100a + 84b = 30 (gam) (1)
Theo bài ra khối lượng chất rắn sau phản ứng là 30 : 2 = 15 gam
⇒ Chọn A.