Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{H_2SO_4}=0,3\cdot1=0,3mol\)
\(M\left(OH\right)_2+H_2SO_4\rightarrow MSO_4+2H_2O\)
0,3 0,3
Mà \(n_{M\left(OH\right)_2}=\dfrac{29,4}{M_{M\left(OH\right)_2}}=0,3\)
\(\Rightarrow M_{M\left(OH\right)_2}=98\Rightarrow M_M+2M_O+2M_H=98\)
\(\Rightarrow M_M=64\left(đvC\right)\)
Vậy kim loại M là Cu(đồng).

gọi công thức của muối đó là M2(CO3)x với x là hóa trị của kim loại đó
gọi a là số mol của muối đó
M2(CO3)x + xH2SO4 ---> M2(SO4)x + xH2O + xCO2
a mol --- --- ->ax mol --- -->a mol --- --- --- --- --->ax mol
khối lượng H2SO4 tham gia phản ứng là 98ax gam
=> khối lượng dd H2SO4 là 1000ax gam
khối lượng muối cacbonat là a(2M + 60x) gam
khối lượng muối sunfat là a(2M + 96x) gam
khối lượng khí CO2 bay ra là 44ax gam
theo định luật bảo toàn khối lượng, ta có:
khối lượng dd sau phản ứng là
m = a(2M + 60x) + 1000ax - 44ax = 2aM + 1016ax
theo đề ta có:
(2aM + 96ax)/(2aM + 1016ax) = 14,18/100
triệt tiêu a ở vế trái, quy đồng 2 vế rồi biến đổi ta tính được:
M = 28x
kim loại chỉ có 3 hóa trị từ 1 đến 3
ta thay x lần lượt bằng 1, 2, 3 thì ra được kết quả thích hợp là:
x = 2 và M = 56
=> kim loại đó là Fe
=> khối lượng dd H2SO4 là 1000ax gam
cho mình hỏi làm sao suy ra được???![]()

Chọn C
Gọi công thức của oxit hóa trị II là RO
Đặt mol RO = 1 (mol)
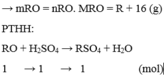
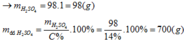
![]()
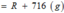
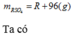

Vậy công thức của oxit kim loại là MgO

Gọi kim loại cần tìm là R(OH)2
PTHH: \(R\left(OH\right)_2+H_2SO_4\rightarrow RSO_4+2H_2O\)
Đặt số mol hidroxit phản ứng là 1 mol
=> \(m_{ddH_2SO_4}=\dfrac{1.98}{17,98\%}=545\left(g\right)\)
=> \(m_{ddsaupu}=M+34+545=M+579\left(g\right)\)
Ta có : \(C\%_{MSO_4}=\dfrac{M+96}{M+579}.100=25\%\)
=> M=65 (Zn)

CT oxit : MO
Đặt số mol oxit phản ứng là 1 mol
\(MO+H_2SO_4\rightarrow MSO_4+H_2O\)
\(m_{ddH_2SO_4}=\dfrac{1.98}{15,8\%}=620,25\left(g\right)\)
\(m_{ddsaupu}=620,25+M+16=M+636,25\left(g\right)\)
Ta có : \(C\%_{MSO_4}=\dfrac{M+96}{M+636,25}.100=22,959\)
=> M=65 (Zn)
=> Oxit kim loại : ZnO (Kẽm oxit)

Đặt \(n_M=x\left(mol\right)\)
Gọi n là hóa trị của M (\(1\le n\le3\) )
\(2M+nH_2SO_4\rightarrow M_2\left(SO_4\right)_n+nH_2\)
x------> 0,5nx-----> 0,5x---------> 0,5nx
\(m_{dd.H_2SO_4.đã.dùng}=\dfrac{0,5nx.98.\left(100+20\right)}{100}=58,8nx\left(g\right)\)
=> \(m_{dd.H_2SO_4.đã.dùng}=\dfrac{58,8nx.100}{20}=294nx\left(g\right)\)
\(\Rightarrow m_{dd.muối}=m_M+m_{dd.H_2SO_4.đã.dùng}-m_{H_2}=Mx+294nx-0,5nx.2=Mx+293nx\left(g\right)\)
\(m_{muối}=0,5x\left(2M+96n\right)=Mx+48nx\left(g\right)\)
\(C\%_{muối}=\dfrac{\left(Mx+48nx\right).100}{Mx+293nx}=23,68\%\)
\(\Leftrightarrow\dfrac{Mx+48nx}{Mx+293nx}=0,2368\)
\(\Leftrightarrow0,2368Mx+69,3824nx-Mx-48nx=0\)
\(\Leftrightarrow-0,7632Mx=-21,3824nx\)
\(\Leftrightarrow M=\dfrac{-21,3824nx}{-0,7632x}=28n\)
Nếu n = 1 => M = 28 (loại)
Nếu n = 2 => M = 56 (nhận)
Nếu n = 3 => M = 84 (loại)
Vậy M là kim loại Fe
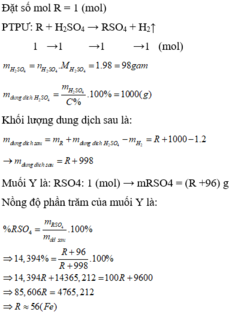
H2SO4 20 % ạ. sai sót
M(OH)2 + H2SO4 ----->MSO4 + 2H2O
1---------------1-----------------1
Coi ban đầu có 1 mol H2SO4>>mH2SO4 = 98
>>mdd H2SO4 = 98/20*100 = 490
mdd sau phản ứng =(M+17*2)+490=M + 524
Vì MSO4 có nồng độ bằng 27,21& nên
(M+96)/(M+524) = 0.2721
>>M = 64 (Cu)