Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

D
Xét ion X + : có 5 nguyên tử, tổng số proton là 11. Vậy số proton trung bình là 2,2.
=> Có 1 nguyên tử có số proton nhỏ hoặc bằng 2 và tạo thành hợp chất. Vậy nguyên tử đó là H

Số electron trung bình của các nguyên tử trong Y 2 - là 9,6
=> Có 1 nguyên tử có số electron nhỏ hơn 9,6
=> Nguyên tử của nguyên tố thuộc chu kì 2.
=> Nguyên tử của nguyên tố còn lại thuộc chu kì 3.
Nếu 2 nguyên tố cùng thuộc một nhóm A thì sẽ hơn kém nhau 8 electron


Tìm cation X+: Ta sẽ làm một bài hóa nhỏ: “Hợp chất X do 5 nguyên tố phi kim loại tạo nên, biết rằng tổng số proton trong X là 11. Tìm X”
+ Để cho dữ liệu gồm tổng số proton và tổng số nguyên tố tạo nên vì vậy ta sẽ nghĩ ngay đến trị số proton trung bình từ đó ta có: Z ¯ = 11 5 = 2 , 2 ⇒ Phải có 1 nguyên tố có số proton bé hơn 2 Chỉ có thể là H (do He là khí hiếm)
Gọi X là AHy theo giả thiết ta có:
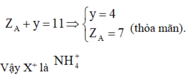
Tìm anion Y3- : Tương tự ta cũng sẽ làm bài hóa nhỏ sau: “Hợp chất Y do 5 nguyên tố phi kim thuộc 2 chu kỳ kế tiếp trong bảng tuần hoàn và có số thứ tự cách nhau 7 đơn vị tạo nên. Biết rằng tổng số proton trong Y là 47. Tìm Y”
Tương tự chúng ta cũng sẽ khai thác trị số proton trung bình:
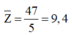
Do đó phải có 1 nguyên tố có số proton nhỏ hơn 9,4 (chu kỳ 2 hoặc 1).
Mặt khác theo giả thiết ta có 2 nguyên tố phi kim tạo nên Y thuộc 2 chu kỳ liên tiếp
=> Hai nguyên tố đó thuộc chu kỳ 2 và chu kỳ 3.
Chu kỳ 3 có các phi kim Si(14); P(15); S(16); 17 (Cl)
Từ đó ta suy ra được các cặp là (Si – N); (P – O); (S – F).
Dễ dàng nhận thấy cặp thỏa mãn là (P – O) với ion P O 4 3 -
Vậy Z là (NH4)3PO4 từ đó ta có:
A: Đúng: Phân tử khối của Z là 133
B: Đúng: Trong Z chỉ chứa liên kết ion (giữa và ) và liên kết cộng hóa trị (giữa N và H; giữa P và O)
C: Đúng: Z chứa ion nên Z phản ứng được với NaOH theo phương trình
![]()
D: Sai: Z phản ứng được với AgNO3 tạo kết tủa Ag3PO4 (màu vàng)
Đáp án D.

Theo 4 đáp án X+ là NH4+
ion Y 2- có tổng số e là 50 và do 2 nguyên tố tạo thành.
♦ Đáp án A: tổng số e: 24+8.4+2=58 → loại
♦ Đáp án B: tổng số e: 16.2+8.3+2=58 → Loại
♦ Đáp án C: loại do có 3 chất tạo thành
♦ Đáp án D: tổng số e: 16+8.4+2=50 → thỏa mãn
Đáp án D

Đáp án C
Hướng dẫn Vì M + 2e → M2- do đó cấu hình electron của M là 1s22s22p43s23p4 và ở ô số 16 chu kì 3 nhóm VIA. CT hợp chất có hóa trị cao nhất với oxi là SO3

Ta có: \(\left\{{}\begin{matrix}3X+Y=149\\Y>5X\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}0< X< 18,6\left(1\right)\\93,2< Y< 149\left(2\right)\end{matrix}\right.\)
Vì X là ion 5 nguyên tử có nguyên tử khối thoả mãn (1) nên X chỉ có thể là \(NH_4^+\)
Do đó T có điện hoá trị cao nhất là +5. Đối chiếu với điều kiện (2) thì Ythoả mãn là ion \(PO_4^{3-}\)
Vậy CTPT của A là \(\left(NH_4\right)_3PO_4\) (Thoả mãn NTK = 149)
