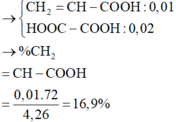
![]()
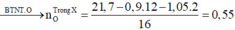
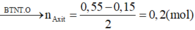

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

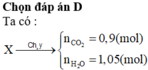
![]()
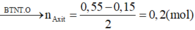


Đáp án D
Đốt cháy hoàn toàn 21,7 gam X thu được 0,9 mol CO2 và 1,05 mol H2O.
Do số mol H2O > CO2 nên ancol là no.

Vậy axit là C2H5COOH còn ancol là C2H5OH.
Este tạo ra là C2H5COOC2H5 0,09 mol vậy m=9,18 gam

Đáp án : D
,nCO2 = 0,9 mol < nH2O = 1,05 mol
Vì axit no đơn chức => ancol đơ chức là ancol no
=> nancol = nH2O – nCO2 = 0,15 mol
Bảo toàn khối lượng : mX + mO2 = mCO2 + mH2O
=> nO2 = 1,15 mol
Bảo toàn O : 2naxit + nancol + 2nO2 = 2nCO2 + nH2O
=> naxit = 0,2 mol
Công thức của axit là CnH2nO2 và ancol là CmH2m+2O
=> mX = 0,2.(14n + 32) + 0,15.(14m + 18) = 21,7g
=> 4n + 3m = 18
=> n = 3 và m = 2 thỏa mãn
C2H5COOH + C2H5OH -> C2H5COOC2H5 + H2O
=> Hiệu suất tính theo ancol ( số mol ancol nhỏ hơn)
=> neste = nancol.60% = 0,09 mol
=> m = 9,18g

Chọn đáp án A
E gồm axit dạng C n H 2 n - 2 O 2 (đơn, hở, 1πC=C) và ancol dạng C m H 2 m + 2 (no, đơn, hở).
♦ giải đốt m gam E + 0 , 15 m o l O 2 → t 0 0 , 12 m o l C O 2 + 0 , 13 m o l H 2 O
Tương quan đốt: ∑ n H 2 O - ∑ n C O 2 = n a n c o l – n a x i t = 0 , 01 m o l 1
• bảo toàn nguyên tố O có 2 n a x i t + n a n c o l = 2 n C O 2 + n H 2 O - 2 n O 2 = 0 , 07 m o l 2
Giải hệ (1) và (2) có nancol = 0,03 mol và naxit = 0,02 mol.
→ ∑ n C O 2 = 0 , 02 n + 0 , 03 m = 0 , 12
⇒ 2n + 3m = 12 với m, n nguyên và n ≥ 3; m ≥ 1
⇒ cặp nghiệm duy nhất thỏa mãn là n = 3 và m = 2 tương ứng với hỗn hợp E gồm:
0,02 mol axit C H 2 = C H C O O H (axit acrylic) và 0,03 mol ancol C H 3 C H 2 O H (ancol etylic).
♦ phản ứng este hóa: C 2 H 3 C O O H + C 2 H 5 O H ⇄ C 2 H 3 C O O C 2 H 5 + H 2 O
ancol dư hơn axit (0,03 > 0,02)
⇒ hiệu suất tính theo số mol của axit
⇒ a = meste = 0,02 × 0,6 × 100
= 1,20 gam.

Đáp án B
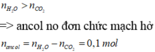
Áp dụng định luật bảo toàn khối lượng cho phản ứng đốt cháy ta có:
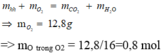
Áp dụng định luật bảo toàn nguyên tố oxi:
nO trong ancol + nO trong axit + nO trong O2
= nO trong CO2 + nO trong H2O
=> nO trong axit = 2.0,3 + 0,4 - 0,1 - 0,8 = 0,1 mol
=> naxit= 0,05 mol
Gọi m, n lần lượt là số ntử C của ancol, axit m ≠ n
=> 0,1m + 0,05n = 0,3
=> m =1, n=4
=> CTPT: CH3OH, C3H7COOH
=> CT este C3H7COOCH3
=> phản ứng este hóa, ancol dư 0,05 mol, axit hết
=> meste lí thuyết = 005.102 = 5,1 g
=> meste thực tế = 5,1.80% = 4,08g

Đáp án : C
nCO2 = 0,13 mol ; nH2O = 0,15 mol
Vì nH2O > nCO2 => 2 ancol đều no.
Este hóa m gam X thì chỉ thu được este => số mol COOH = số mol OH
Gọi số mol axit đơn chức là a và axit 2 chức là b mol => nancol = a + 2b
=> nH2O – nCO2 = nancol – naxit. (p - 1)
=> 0,02 = a + 2b – (p - 1)(a + b) = 2a + 3b - p(a + b)
=> p < 3 và p > 1 để biểu thức dương
=> p = 2 => axit đơn chức có 1 liên kết C=C và axit 2 chức no
Và b = 0,02 mol
=> nancol = 0,04 + a => Khi phản ứng este hóa : nH2O = nancol = 0,04 + a mol
=> bảo toàn nguyên tố : nO(X) = 3a + 0,12 mol
=> mX = 0,13.12 + 0,15.2 + 16.(3a + 0,12) g
Bảo toàn khối lượng : mX = meste + mH2O
=> 1,86 + 16.(3a + 0,12) = 3,36 + 18.(0,04 + a)
=> a = 0,01 mol
=> nX = 0,01 + 0,02 + 0,05 = 0,08 mol
=> Số C trung bình = 1,625
=> ancol CH3OH.
Số H trung bình = 3,75 => axit 2 chức là (COOH)2
Gọi 2 chất : axit đơn chức CnH2n-2O2 và hỗn hợp ancol CmH2m+2O
,mX = 4,26g
Bảo toàn C : 0,01n + 0,05m = 0,13 – 0,04 = 0,09
=> n + 5m = 9 . mà m > 1 vì trong hỗn hợp ancol có CH3OH
=> n < 4. Mà axit có 1 liên kết C=C => axit là CH2=CHCOOH
=> %mCH2=CHCOOH = 16,90%

Định hướng tư duy giải
Bài toán này không nhiều chữ, dữ kiện cũng khá thoáng. Tuy nhiên, cũng là một bài toán khá hay. Cái hay và vẻ đẹp của nó là tính logic trong sự kín đáo. Nếu không có tư duy tinh tế sẽ khó mà giải quyết được bài toán này. Do đó, với bài toán này tôi xin phép được trình bày “hơi dài” mong các bạn cố gắng đọc hết.
Đầu tiên ta có: n CO 2 = 0 , 13 n H 2 O = 0 , 15
→ Ancol phải là no, đơn chức.
Thực hiện este hóa chỉ thu được este → nOH = nCOOH = a (mol).
→ BTKL 0 , 13 . 12 + 0 , 15 . 2 + 48 a = 3 , 36 + 18 a
=> a = 0,05 (mol).
Biện luận: Làm trội liên kết π
Gọi X
A : RCOOH : a B : HOOC - R ' - COOH : → a + 2 b = c C : ancol : c
Đương nhiên số liên kết π trong các axit phải không nhỏ hơn 2. Ta sẽ biện luận rằng nó cũng không thể vượt quá 2.
Vì nếu trong A, B có 3 liên kết π để số mol H2O > số mol CO2
→ ta phải có c > 2(a+b) (điều này là vô lý) → A, B có hai liên kết π.
Để tìm số mol các axit, tôi xin giới thiệu với các bạn kỹ thuật dồn biến N.A.P
(Tôi sẽ cho thêm các bạn vài CÂU để các bạn luyện tập kỹ thuật dồn biến này)
Ta có:
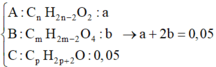
Ta đã biết số mol CO2 → Ta sẽ dồn H, O sao cho số mol CO2 = số mol H2O (ảo) mục đích để BTKL.
→ BTKL m X = 3 , 36 + 18 . 0 , 05 = 0 , 13 . 14 + 30 a + 62 b + 18 . 0 , 05
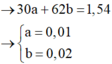
Biện luận: Làm trội số nguyên tử C.
+ Các bạn cần phải để ý tới n CO 2 = 0 , 13 mol → Nếu các ancol có nhiều hơn 2 nguyên tử C → Vô lý ngay.
+ Và

Nếu ta tăng thêm 1 nguyên tử C trong A hay B cũng sẽ làm số mol CO2 vô lý ngay