Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
nSO2 = 1,7 (mol)
Chất rắn Z là Fe2O3, nFe2O3 = 0,4 (mol)
2Febđ → Fe2O3
0,8 ← 0,4 (mol)
Ta có: mX = 1,7 ×64 – 48=60,8 (gam)
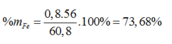

`2Fe + 6H_2 SO_[4(đ,n)] -> Fe_2(SO_4)_3 + 6H_2 O + 3SO_2 \uparrow`
`0,1` `0,15` `(mol)`
`2Ag + 2H_2 SO_[4(đ,n)] -> Ag_2 SO_4 + 2H_2 O + SO_2 \uparrow`
`0,2` `0,1` `(mol)`
`n_[SO_2]=[5,6]/[22,4]=0,25(mol)`
Gọi `n_[Fe]=x` ; `n_[Ag]=y`
`=>` $\left[\begin{matrix} 56x+108y=27,2\\ \dfrac{3}{2}x+\dfrac{1}{2}y=0,25\end{matrix}\right.$
`<=>` $\left[\begin{matrix} x=0,1\\ y=0,2\end{matrix}\right.$
`a)%m_[Fe]=[0,1.56]/[27,2] .100~~20,59%`
`=>%m_[Ag]~~100-20,59~~79,41%`
`b)n_[SO_2]=0,15+0,1=0,25(mol)`
`n_[NaOH]=0,5.0,8=0,4(mol)`
Ta có:`T=[0,4]/[0,25]=1,6 ->` Tạo muối `Na_2 SO_3` và `NaHSO_3`
`SO_2 + 2NaOH -> Na_2 SO_3 + H_2 O`
`SO_2 + NaOH -> NaHSO_3`
Gọi `n_[Na_2 SO_3]=x ; n_[NaHSO_3]=y`
`=>` $\left[\begin{matrix} x+y=0,25\\ 2x+y=0,4\end{matrix}\right.$
`<=>` $\left[\begin{matrix} x=0,15\\ y=0,1\end{matrix}\right.$
`=>C_[M_[Na_2 SO_3]]=[0,15]/[0,5]=0,3(M)`
`=>C_[M_[NaHSO_3]]=[0,1]/[0,5]=0,2(M)`
Lần sau chú ý dùng dấu \(\left\{{}\begin{matrix}\\\end{matrix}\right.\) ha, dấu \(\left[{}\begin{matrix}\\\end{matrix}\right.\) có ý nghĩa là xảy ra một trong các trường hợp còn dấu \(\left\{{}\begin{matrix}\\\end{matrix}\right.\) có ý nghĩa là đồng thời xảy ra

\(Đặt:n_{MnO_2}=a\left(mol\right),n_{KMnO_4}=b\left(mol\right)\)
\(m_{hh}=87a+158b=37.96\left(g\right)\left(1\right)\)
\(n_{Cl_2}=\dfrac{10.08}{22.4}=0.45\left(mol\right)\)
\(2KMnO_4+16HCl\rightarrow2KCl+2MnCl_2+5Cl_2+8H_2O\)
\(MnO_2+4HCl\rightarrow MnCl_2+Cl_2+2H_2O\)
\(n_{Cl_2}=a+2.5b=0.45\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.4,b=0.02\)
\(\%MnO_2=\dfrac{0.4\cdot87}{37.96}\cdot100\%=91.68\%\\\%KMnO_4=100-91.68=8.32\% \)
\(m_M=m_{KCl}+m_{MnCl_2}=0.02\cdot74.5+\left(0.4+0.02\right)\cdot126=54.41g\)

Đáp án D.
Gọi nCu = y, nFe = x mol

Áp dụng định luật bảo toàn e ta có: 3x+2y = 0,7 (1)
Khối lượng hai kim loại = 1,84 g: 56x+64y = 184 (2).
Giải 1,2 ta có: x = 0,1, y = 0,2 (mol)
% m F e = 0 , 1 . 56 18 , 4 . 100 % = 30 , 43 %

Đáp án B
Fe là kim loại yếu hơn Al =>Al phản ứng trước, Fe phản ứng sau => 2,4 gam kim loại chính là Fe dư
Gọi số mol các chất là Al: a mol; Fe (pứ): b mol
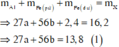
KMnO4 là chất oxi hoá mạnh, trong môi trường axit sẽ oxi hoá Fe + 2 lên Fe + 3 , Cl - 1 lên Cl 2 0 và bản thân Mn + 7 bị khử xuống Mn + 2
Như vậy, khi xét cả quá trình thì chỉ có Al, Fe và KMnO4 thay đổi số oxi hoá:
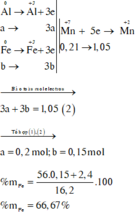
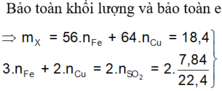
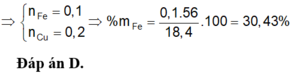
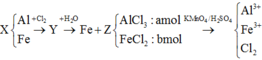
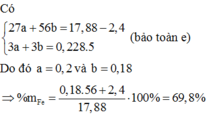
\(2KMnO_4+16HCl_{đặc,nóng}\rightarrow2KCl+2MnCl_2+5Cl_2+8H_2O\\ MnO_2+4HCl_{đặc,nóng}\rightarrow MnCl_2+Cl_2+2H_2O\\ Đặt:n_{KMnO_4}=a\left(mol\right);n_{MnO_2}=b\left(mol\right)\left(a,b>0\right)\\ Vì:n_{Cl_2}=\dfrac{9,632}{22,4}=0,43\left(mol\right)\\ \Rightarrow2,5a+b=0,43\left(1\right)\\ Ta.có:n_O=4a+2b\Rightarrow m_O=16.\left(4a+2b\right)=64a+32b=0,39114.\left(158a+87b\right)\\ \Leftrightarrow64a+32b-61,80012a-34,02918b=0\\ \Leftrightarrow2,19988a-2,02918b=0\left(2\right)\\ \left(1\right),\left(2\right)\Rightarrow\left\{{}\begin{matrix}2,19988a-2,02918b=0\\2,5a+b=0,43\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,12\\b=0,13\end{matrix}\right.\)
\(n_{MnCl_2}=n_{MnO_2}=a+b=0,25\left(mol\right)\\ \Rightarrow m_{MnCl_2}=126.0,25=31,5\left(g\right)\)
=>Chọn D