Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
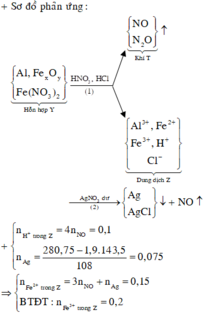
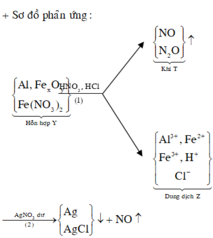
+ Dung dịch Z phản ứng với dung dịch AgNO3 dư thu được khí NO, chứng tỏ trong Z có Fe2+, H+ và không còn NO 3 -


Đáp án A
Sơ đồ 1:
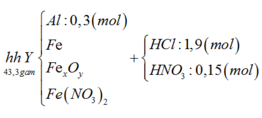
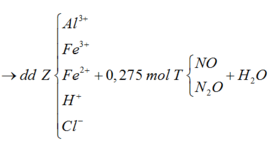
Sơ đồ 2:
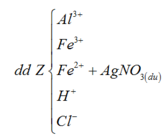
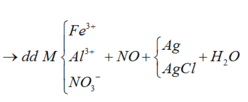
Từ sơ đồ 2 ta có:
BTNT Cl à số mol AgCl = 1,9 (mol) à Số mol Ag = 0,075 (mol)
Số mol H+ dư trong Z = 4nNO = 0,1 (mol)
Bảo toàn e ta có số mol Fe2+ (trong Z) = 3nNO + nAg = 0,15 (mol)
Bảo toàn điện tích cho dung dịch Z ta có: Số mol Fe3+ = 0,2 (mol)
Từ sơ đồ 1 ta có:
Số mol H2O = 1 , 9 + 0 , 15 - 0 , 1 2 = 0 , 975 ( m o l )
BTKL ta có: mkhí T = 9,3 (gam) à n N O + n H 2 O = 0 , 275 30 n N O + 44 n N 2 O = 9 , 3 → n N O = 0 , 2 n N 2 O = 0 , 075
BTNT (N) ta có số mol Fe(NO3)2 = 0 , 2 + 0 , 075 . 2 - 0 , 15 2 = 0 , 1 ( m o l )
à %m(Fe(NO3)2 = 180 . 0 , 1 43 , 3 . 100 % = 41 , 57 %

Chọn A.
Rắn Y chứa 3 kim loại là Ag, Cu, Fe (z mol) và dung dịch Z chứa Mg(NO3)2 (x mol) và Fe(NO3)2 (y mol) Ta có:
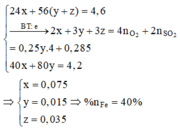

Ta có sơ đồ sau: A(Fe ; Cu) + AgNO3 → dd Y ; Y + Zn → 28,7g Z Do m Zn < m Z => Ag+ dư
Xét trên toàn bộ quá trình thì chỉ có Ag+ và Zn là thay đổi số oxi hóa
=>Bảo toàn e: n e trao đổi Fe,Cu = n Ag+ = 2nZn phản ứng
=> n Zn phản ứng = 0,2 mol
=> n Zn trong Z = 0,22 mol
nl=> m Fe + m Cu + m Ag = 62,4 + 27,3 + 28,7 – 0,22.65 = 41,7g
=>m Fe + m Cu = 33,6g
=> n Fe = 0,24 mol ; n Cu = 0,315 mol
=> n HNO3 tối thiểu khi chỉ oxi hóa Fe lên Fe2+
=> n HNO3 = 8/3. (nFe + n Cu) = 1,48 mol
=>C

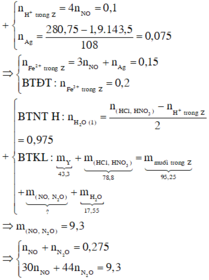
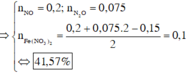
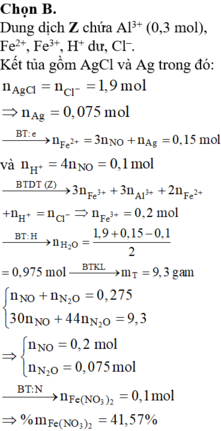

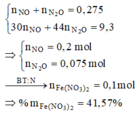
Đáp án A