
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

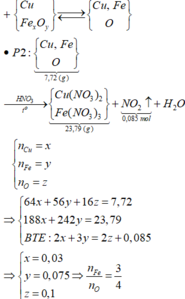
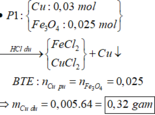

Chất rắn m1 là Cu. Bảo toàn e có 2nCu=3nNO
→ 2b = 2V/70
Gọi số mol: Mg là x; Cu là y; Al là z và NH4NO3 là t
Ta có hệ phương trình
(1) 2x +3y = 2n(H2) = 0,88
(2) 24x + 64y + 27z = 19,92
(3) 148x + 188y + 213z + 80t = 97,95
(4) 2x + 2y + 3t = 3n(NO) + 8n(NH4NO3) = 3V/22,4 + 8t = 6,25y + 8t
→ x = 0,08; y = 0,18; z = 0,24
→ %Mg = 9,64% → Đáp án B

Đáp án B
P1 : + NaOH có khí H2 => Al dư , FexOy hết
=> mFe = 5,04g => nFe = 0,09 mol ; nAl dư = 0,03 mol = 2/3nH2
=> nFe + nAl = 0,12 mol
P2 : Fe và Al phản ứng tạo NO => nFe + nAl = nNO (bảo toàn e) = 0,36 mol = 3nP1
=> mP1 = 1/3mP2 = 9,93g => m = 9,93 + 29,79 = 39,72g
Xét P1 : mAl2O3 + mFe + mAl = mP1 = 9,93g => nAl2O3 = 0,04 mol => nO = 0,12 mol
=> nFe : nO = 0,09 : 0,12 = 3 : 4 => Fe3O4
=>B

Định hướng tư duy giải
→ n NH 4 + = 0 , 235 . 2 - 0 , 14 . 3 8 = 0 , 00625
=> 110,23 = 0,73943m + 96.(0,235+0,26057m/16) => m = 38,07
=> mY = 28,15 + 62.(0,00625.8 + 0,14.3 + 0,62.2) + 80.0,00625 = 134,67

Đáp án B
Giải:
Phần 1: có H2 thoát ra => Al dư . nAl dư = 2/3 nH2 = 0,03
Chất rắn không tan là Fe , nFe = 0,09 => tỉ lệ mol Al và Fe là 1:3 Phần 2 : Đặt nAl=a , nFe=b
Ta có : 3a=b , 3a+3b=3nNO= 1,08 => a=0,09 ; b=0,27 => nAl2O3 = 0,12
Tỉ lệ mol của Al và Al2O3 là 3:4 => nAl2O3 trong phần 1 = 4/3 nAl=0,04
Vậy m = mAl + mFe + mAl2O3 = 0,03.27+0,04.102+5,04+29,79=39,72g
nFe = 0,09 ; nO=3 nAl2O3=0,12 => nFe:nO=3/4 => oxit sắt là Fe3O4