Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

5.
\(n_X=\dfrac{2,24}{22,4}=0,1mol\\ M_X=2,125.4=8,5g\cdot mol^{^{ }-1}\\ n_{H_2}=a;n_{C_2H_4}=b\\ a+b=0,1\\ 2a+28b=8,5.0,1=0,85\\ a=0,075;b=0,025\\ H_2+C_2H_4-^{^{ }Ni,t^{^{ }0}}->C_2H_6\\ V_{C_2H_6}=0,025.22,4=0,56L;V_{H_2dư}=22,4\left(0,075-0,025\right)=1,12L\)
6.
Thu được Y chỉ gồm hydrocarbon nên khí hydrogen phản ứng hết.
\(n_A=\dfrac{4,48}{22,4}=0,2mol\\ n_Y=\dfrac{3,36}{22,4}=0,15mol\\ \Delta n_{hh}=n_{H_2\left(pư\right)}=0,05\left(mol\right)\\ n_{C_2H_4}=0,15\left(mol\right)\\ a.\%V_{H_2}=\dfrac{0,05}{0,2}=25\%\\ \%V_{C_2H_4}=75\%\\ b.BTLK\pi:0,15=0,05+n_{Br_2}\\ n_{Br_2}=0,1mol\)

trong 1 mol hh ban đầu có nH2 =0,75 mol , nC2H4 =0,25 mol
nsau= 2,125.13/34=0,8125
=> nH2 pứ =ntrc -nsau =1- 0.8125=0,1875
=> H= 0,1875/0,75 .100= 25%


Vì khối lượng của hỗn hợp trước và sau phản ứng là bằng nhau
=> n hh trước phản ứng : n hh sau phản ứng = 25 : 15 = 5 : 3
Coi tổng số mol trước phản ứng là 5 => tổng số mol sau phản ứng là 3 mol
Ta có khối lượng hỗn hợp là : 5 . 15 = 75 g
Ta có hệ :
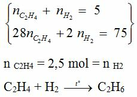
Ban đầu 2,5 2,5
Phản ứng x x
Kết thúc : 2,5 – x 2,5– x x
=> Tổng số mol sau phản ứng là : : 2,5 – x + 2,5– x + x = 5–x
=> 5 – x = 3 => x = 2 mol
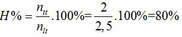

a.
BTKL ta có mX = mY => nX . MX = nY . mY
MX / My = nY / mY =0.75
Đặt nX = 1 mol => nY = 0,75 mol => nH2 phản ứng = 1 – 0,75 = 0,25mol
* TH hidrocacbon là anken: n anken = n H2 = 0,25 mol => n H2 trong X = 0,75 => M = (6,75 – 0,75 . 2)/0,25 = 21 (loại) * TH là ankin: => n akin = 0,25/2 = 0,125 => n H2 trong X = 0,875 mol => M = (6,75 – 0,875 . 2)/0,125 = 40 =>C3H4
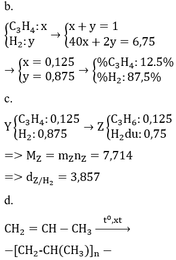


Tính nX= 0,8 mol; nZ= 0,3 mol; MY= 29 g/mol; MZ= 18,3332 g/mol
MX= \(\dfrac{\text{44.1 + 52.1+40.3+28.2+2.9}}{16}\) = 18,125 g/mol
Các hidrocacbon không no đều có chỉ số H= 4 nên đặt công thức chung là CxH4.
*Phản ứng của X với Ni nung nóng:
CxH4+ y H2 → CxH4+2y (1)
Theo bảo toàn khối lượng ta có: mY= mX= 0,8.18,125= 14,5 gam
→ nY= 14,5 : 29= 0,5 mol
Theo phản ứng (1) thấy số mol khí giảm xuống bằng số mol H2 phản ứng
Vậy nH2 phản ứng= 0,8- 0,5= 0,3 mol
*Phản ứng của Y với dung dịch Br2 dư:
Y gồm Z (C3H8, C2H6, C4H10) và các hidrocacbon không no: CnHm
CnHm+ a Br2 → CnHmBr2a (2)
Khối lượng bình brom tăng lên bằng khối lượng hidrocacbon không no trong Y
Bảo toàn khối lượng ta có: mZ+ mCnHm= mY
Nên mbình brom tăng= mCnHm= mY- mZ= 14,5- 0,3.4.4,5833= 9 gam
Xét cả quá trình thì toàn bộ liên kết kém bền đều bị đứt hết
Đặt công thức chung của H2 phản ứng và Br2 phản ứng là X2.
C4H4+ 3X2 → C4H4X6
C3H4+ 2X2 → C3H4X4
C2H4+ X2 → C2H4X2
Tổng số mol liên kết kém bền trong X là n
Ta có: nX2= 3.nC4H4+ 2.nC3H4 + nC2H4= 3.1+2.3+216.0,8=0,55(mol)
Nên nBr2 pứ= nX2- nH2 pứ= 0,55- 0,3= 0,25 mol


⇒ Chọn B.