Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

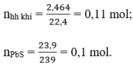
a) Phương trình hóa học của phản ứng:
Fe + 2HCl → FeCl2 + H2 (1)
FeS + 2HCl → FeCl2 + H2S (2)
H2S + Pb(NO3)2 → PbS + 2HNO3 (3)
b) Hỗn hợp khí thu được là H2 và H2S
Theo pt (3) ⇒ nH2S = nPbS = 0,1 mol
⇒ nH2 = nhh khí - nH2S = 0,11 – 0,1 = 0,01 mol
VH2 = 0,01 x 22,4 = 0,224l.
VH2S = 0,1 x 22,4 = 2,24l.
c) Theo PT (2) ⇒ nFeS = nH2S = 0,1 mol
⇒ mFeS = 0,1 × 88 = 8,8g.
Theo PT (1) nFe = nH2 = 0,01 mol ⇒ mFe = 56 × 0,01 = 0,56g.

a, \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: Fe + H2SO4 ---> FeSO4 + H2
0,2<---------------------------0,2
\(\rightarrow\left\{{}\begin{matrix}m_{Fe}=0,2.56=11,2\left(g\right)\\m_{Cu}=16-11,2=4,8\left(g\right)\end{matrix}\right.\)
b, \(\left\{{}\begin{matrix}n_{Fe}=\dfrac{32}{16}.0,2=0,4\left(mol\right)\\n_{Cu}=\dfrac{4,8}{64}.\dfrac{32}{16}=0,15\left(mol\right)\end{matrix}\right.\)
PTHH:
Cu + 2H2SO4 (đặc, nóng) ---> CuSO4 + SO2 + 2H2O
0,15--------------------------------------------->0,15
2Fe + 6H2SO4 (đặc, nóng) ---> Fe2(SO4)3 + 3SO2 + 6H2O
0,4------------------------------------------------------>0,6
=> VSO2 = (0,6 + 0,15).22,4 = 16,8 (l)
c, \(n_{NaOH}=0,375.2=0,75\left(mol\right)\)
\(T=\dfrac{0,75}{0,6+0,15}=1\) => tạo duy nhất muối axit (NaHSO3)
PTHH: NaOH + SO2 ---> NaHSO3
0,75----------------->0,75
=> mmuối = 0,75.104 = 78 (g)

a/ \(n_{SO_2}=\dfrac{3,08}{22,4}=0,1375\left(mol\right);n_{H_2}=\dfrac{1,68}{22,4}=0,075\left(mol\right)\)
2Fe + 6H2SO4(đ) ---to---> Fe2(SO4)3 + 6SO2 + 3H2O
x 3x
Cu + 2H2SO4(đ) ---to---> CuSO4 + SO2 + 2H2O
y y
Fe + 2HCl ----> FeCl2 + H2
x x
Cu + 2HCl -----> CuCl2 + H2
y y
Ta có hệ pt: \(\left\{{}\begin{matrix}3x+y=0,1375\\x+y=0,075\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,03125\left(mol\right)\\y=0,04375\left(mol\right)\end{matrix}\right.\)
\(m_{hh}=0,03125.56+0,04375.64=4,55\left(g\right)\)
\(\%m_{Fe}=\dfrac{0,03125.56.100\%}{4,55}=38,46\%\)
b, \(n_{Ba\left(OH\right)_2}=0,1.1,2=0,12\left(mol\right)\)
Ta có: \(T=\dfrac{n_{SO_2}}{n_{Ba\left(OH\right)_2}}=\dfrac{0,1375}{0,12}=1,1458\)
=> tạo ra 2 muối là BaSO3 và Ba(HSO3)2
SO2 + Ba(OH)2 ---> BaSO3 + H2O
x x x
2SO2 + Ba(OH)2 ----> Ba(HSO3)2
y 0,5y 0,5y
Ta có hệ pt: \(\left\{{}\begin{matrix}x+y=0,1375\\x+0,5y=0,12\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1025\left(mol\right)\\y=0,035\left(mol\right)\end{matrix}\right.\)
\(m_{muối}=0,1025.217+0,5.0,035.299=27,475\left(g\right)\)

Đáp án C.
Kim loại không phản ứng với H2SO4 loãng là Cu.
Gọi nCu = x, nMg = y, nAl = z
Ta có:
64x + 24y + 27z = 33,2 (1)
Bảo toàn e:
2nMg + 3nAl = 2nH2
=> 2y + 3z = 2.1 (2)
2nCu = 2nSO2 => x = 0.2 (mol) (3)
Từ 1, 2, 3 => x = 0,2; y = z = 0,4 (mol)
mCu = 0,2.64 = 12,8 (g)
mMg = 0,4.24 = 9,6 (g)
mAl = 10,8 (g)

a) \(n_{PbS}=\dfrac{23,9}{239}=0,1\left(mol\right)\)
=> \(n_{H_2S}=0,1\left(mol\right)\)
\(\%V_{H_2S}=\dfrac{0,1.22,4}{2,464}.100\%=90,9\%\)
\(\%V_{H_2}=100\%-90,9\%=9,1\%\)
b) \(n_{H_2}=\dfrac{2,464.9,1\%}{22,4}=0,01\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
0,01<-------------------0,01
FeS + 2HCl --> FeCl2 + H2S
0,1<---------------------0,1
=> \(\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,01.56}{0,01.56+0,1.88}.100\%=5,983\%\\\%m_{FeS}=\dfrac{0,1.88}{0,01.56+0,1.88}.100\%=94,017\%\end{matrix}\right.\)


