Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
nAl = 0,2 mol ; nFe3O4 = 0,075 mol ; nH2 = 0,24 mol
Phản ứng xảy ra không hoàn toàn:
8Al + 3Fe3O4 → 4Al2O3 + 9Fe
x 0,5x (mol)
Hòa tan chất rắn (Fe, Al dư) vào H2SO4 ⇒H2
BT e ta có: 2.nFe + 3.nAl = 2.nH2
⇒ 9/8.x.2 + (0,2 – x).3 = 0,24.2 ⇒ x = 0,16 mol ⇒ Hphản ứng = 0,16/0,2 = 80%
BT e ⇒nH+phản ứng = 2.nFe + 3.nAl + 6.nAl2O3 + 8.nFe3O4 = 0,36 + 0,12 + 0,48 + 0,12 = 1,08 mol
⇒ nH2SO4phản ứng = 1,08/2 = 0,54mol

Đáp án D
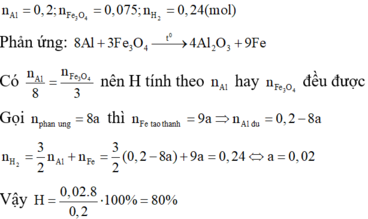
Chú ý: Trong một phương trình phản ứng, để nhẩm nhanh chất nào phản ứng hết trước khi biết cụ thể số mol từng chất trước phản ứng, ta lấy số mol ban đầu của mỗi chất chia hệ số của chất đó trong phương trình phản ứng, chất nào có thương thu được nhỏ nhất thì chất đó hết trước.

Giải thích:
nAl = 0,4 mol ; nFe3O4 = 0,15 mol
Giả sử H = x
![]()
Bd: 0,4 0,15
Pu: 0,4x 0,15x 0,2x 0,45x
Sau: 0,4 – 0,4x 0,45x
nH2 = 1,5nAl + nFe → 0,48 = 1,5(0,4 – 0,4x) + 0,45x
→ x = 0,8
→ H = 80%
Đáp án D

Đáp án A
· Có n Al ( B ) = 2 3 . n H 2 = 2 3 . 0 , 672 22 , 4 = 0 , 02 mol
· Chất rắn thu được sau khi nung là Al2O3:
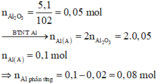
· Quy đổi A tương đương với hỗn hợp gồm 0,1 mol Al, a mol Fe, b mol O
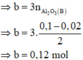
· Phần không tan D gồm Fe và oxit sắt + H2SO4 ® Dung dịch E + 0,12 mol SO2
Dung dịch E chứa một muối sắt duy nhất và không hòa tan được bột Cu
Þ Muối sắt là FeSO4.
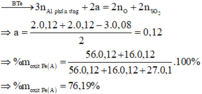

Đáp án A
Ta có : nAl = 10,8 / 27 = 0,4 mol ;
nFe3O4 = 34,8 / 232 = 0,15 mol ; n H2 = 10,752 / 22,4 = 0,48 mol
8 Al + 3 Fe3O4 → 4Al2O3 + 9 Fe
8x/3 x 3x
Gọi số mol Fe3O4 phản ứng là x mol
Vì hiệu suất không đạt 100% nên cả Al và Fe3O4 đều chưa phản ứng hết.
⇒ hỗn hợp chất rắn Al dư, Fe3O4 dư , Al2O3 và Fe.
Theo phản ứng :
n Alp/ư = 8x/3 mol ⇒ nAldư = (0,4 - 8x/3) mol
2 Al + 3 H2SO4 → Al2(SO4)3 + 3H2
(0,4 - 8 3 x ) 3 2 0 , 4 - 8 3 x
Fe + H2SO4 → FeSO4 + H2
3x 3x
⇒ 3/2(0,4 - 8x/3) + 3x = 0,48 ⇒ x = 0,12 mol
⇒ H = 0,12/0,15 . 100% = 80%

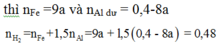
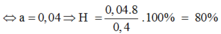
Đáp án A