Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn B
Cu2+:x
Cl-: y
Ở catot thoát ra khí => H2O bị đp
Catot:
Cu2+ +2e → Cu
x 2x
H2O +1e → 0,5H2 + OH-
y-2x 0,5y-x
Anot:
Cl- - 1e → 0,5Cl2
y y 0,5y
=> 0,5y = 4(y-2x) => x/y=3/8
=>%mCuSO4 = 160.3/(160.3+74,5.8) = 44,61%

Đáp án : A
Các quá trình có thể xảy ra ở điện cực :
+) Catot : Cu2+ +2e à Cu
2H2O + 2e à 2 OH- + H2
+) Anot : 2Cl- à Cl2 + 2e
2H2O à 4H+ + O2 + 4e
Điện phân đến khi nước đều bị điện phân ở cả 2 điện cực
=> Cu2+ và Cl- đều bị điện phân hết
Xét TH1 : Y có H+ => nH+ = 3nAl = 0,3 mol => ne ( H+) = ne (Cu2+) => Vô lý
=> Y có OH- => nOH- = nAl = 0,1 mol
=> ne trao đổi = 2nCu2+ + nOH- = nCl- = 0,4 mol = nKCl
=> Y có 0,15 mol K2SO4 và 0,1 mol KOH
mY = mX – mCu – mH2 – mCl2 = 76,1g
=>C%K2SO4(Y) = 34,30%



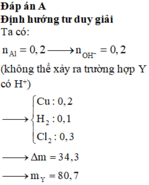
Chọn C.
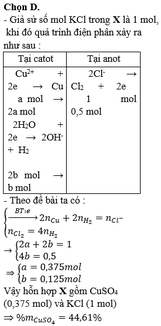
Giả sử số mol KCl trong X là 1 mol, khi đó quá trình điện phân xảy ra như sau:Theo đề bài ta có:
Vậy hỗn hợp X gồm CuSO4 (0,375 mol) và KCl (1 mol)