Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Nếu Fe có hóa trị không đổi ta có sơ đồ quá trình
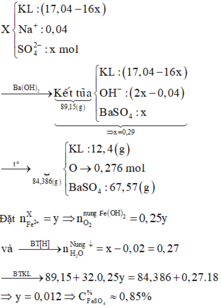
15,6 gam (M, M2On) + (H2SO4, NaNO3) → (N2O: 0,01 mol; NO: 0,02 mol) + H2O + (Mn+, Na+, SO42− -+BaSO4 → 89,15 gam (M(OH)n, BaSO4)
bảo toàn N có: nNaNO3 = 0,04 mol. gọi nO trong oxit = x mol.
bỏ cụm SO4 2 vế, bảo toàn nguyên tố O có nH2O = x + 0,09 mol.
bảo toàn H có nH2SO4 = (x + 0,09) mol. Theo đó, 89,15 gam kết tủa gồm:
15,6 – 16x) gam M + 2x + 0,09 × 2 – 0,04Na+ mol OH và (x + 0,09) mol BaSO4.
⇒ giải x = 0,2 mol. Xét tiếp phản ứng nung 89,15 gam kết tủa:
2M(OH)n → M2On + nH2O (đơn giản: 2OH → 1O + 1H2O).
⇒ mchất rắn sau nung = 89,15 – 0,27 × 18 = 84,29 gam < 84,386 theo giả thiết.
→ FeSO4 → Fe(OH)2 → FeO mà thực tế: 2FeO + O → Fe2O3.
⇒ nFeO = 2 × 84,386 – 84,29) ÷ 16 = 0,012 mol ⇄ nFeSO4 = 0,012 mol.
Lại có mX = 15,6 + 200 – 0,01 × 44 – 0,02 × 30 = 214,56 gam
⇒ C%FeSO4 trong X = 0,012 × 152 ÷ 214,56 × 100% ≈ 0,85%.

Đáp án A
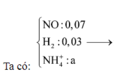
Bảo toàn N => nNaNO3 = 2nN2O + nNO = 0,04
Đặt nH2SO4 = a và nO trong hỗn hợp ban đầu = b
=> nH+ = 2a = 2b + 0,01.10 + 0,02.4 (1 )
nBa(OH)2 = nBaSO4 = a
nNaOH = nNaNO3 = 0,04
Bảo toàn OH- => nOH trong↓ = 2a - 0,04
=> m↓ = 233a + (15,6 - 16b) + 17(2a - 0,04) = 89,15 (2)
(1)(2) => a = 0,29 và b = 0,2
Đặt nFe2+ = c
Bảo toàn electron => nO2 phản ứng với↓= 0,25c
Bảo toàn H => nH2O khi nung ↓ = a - 0,02 = 0,27
m rắn = 89,15 + 32.0,25c - 18.0,27 = 84,386
=>c = 0,012
mdd X= 15,6 + 200 - mY = 214,56
=> C%FeSO4 = 0 , 012 . 152 214 , 56 . 100% = 0,85%

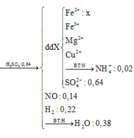
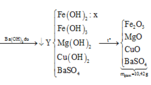
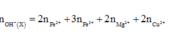

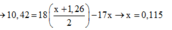
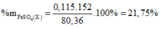

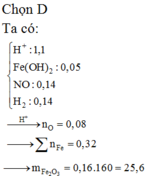
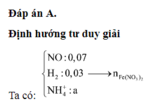
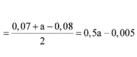
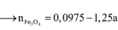
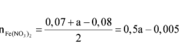
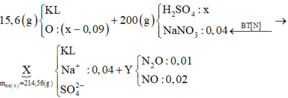
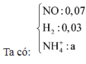
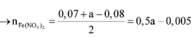
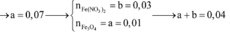
Đáp án D