Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Do khi phản ứng với NaOH tạo khí nên Al dư, oxit sắt hết .
Z là Fe.
2Fe+ 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O
=> n Fe = 0,2 mol => n Fe (Z)= 0,8 mol
Lại có n H2 = 0,375 mol
=> nAl (Z) =0,25 mol
=> m Al2O3(Z)= 92,35 – 56.0,8 – 0,25.27 =40,8 g =>B

2yAl + 3FexOy ---> yAl2O3 + 3xFe (1) Chất rắn B gồm Al2O3, Fe và Al dư (vì phản ứng xảy ra hoàn toàn nên FexOy không dư).
0,08 0,04 0,08
Al(dư) + NaOH + H2O ---> NaAlO2 + 3/2H2 (2)
0,02 0,02 0,03 mol
Al2O3 + 2NaOH ---> 2NaAlO2 + H2O (3) Phần không tan D là Fe.
NaAlO2 + HCl + H2O ---> Al(OH)3\(\downarrow\)+ NaCl (4)
2Al(OH)3 ---> Al2O3 + 3H2O (5) (5,1 gam chất rắn là Al2O3).
0,1 0,05 mol
2Fe + 6H2SO4 ---> Fe2(SO4)3 + 3SO2\(\uparrow\) + 6H2O (6)
0,08 0,12 mol
Theo pt(4) và (5) số mol NaAlO2 = số mol Al(OH)3 = 0,1 mol. Do đó số mol NaAlO2 ở pt (3) = 0,1 - 0,02 = 0,08 mol. Suy ra số mol Al2O3 sinh ra ở pư (1) = 0,04 mol.
Theo pt(6) số mol Fe = 0,08 mol. Như vậy, từ pt (1) ta có: 2y = 3x hay x/y = 2/3. Suy ra: Fe2O3.
m = mAl + mFe2O3 = 27(0,08 + 0,02) + 160.0,04 = 9,1 gam.

Đáp án : A
Ba + 2H2O -> Ba(OH)2 + H2
Ba(OH)2 + 2Al + H2O -> Ba(AlO2)2 + 3H2
=> nH2 = 4nBa = 0,4 mol => nBa = 0,1 mol
Vì X +NaOH tạo nH2 = 0,7 mol > 0,4 mol => chứng tỏ Al dư ở thí nghiệm đầu
=> nH2 do Al = nH2 (2) – nH2(1) = 0,3 mol
=> nAl = 2/3 nh2 do Al = 0,2 mol
=> mX = 19,1g

Câu 1/
\(2C\left(\dfrac{m}{12}\right)+O_2\left(\dfrac{m}{24}\right)\rightarrow2CO_2\left(\dfrac{m}{12}\right)\)
\(CO_2\left(\dfrac{m}{12}\right)+Ca\left(OH\right)_2\rightarrow CaCO_3\left(\dfrac{m}{12}\right)+H_2O\)
Nếu như O2 thì tỷ khối của hỗn hợp so với O2 phải là: \(\dfrac{44}{32}=1,375>1,25\) vậy trong hỗn hợp khí phải có O2
\(n_C=\dfrac{m}{12}\left(mol\right)\)
\(n_{O_2}=\dfrac{V}{22,4}\left(mol\right)\)
\(\Rightarrow n_{O_2\left(dư\right)}=\dfrac{V}{22,4}-\dfrac{m}{12}\left(mol\right)\)
\(\Rightarrow\dfrac{44.\dfrac{m}{12}+32.\left(\dfrac{V}{22,4}-\dfrac{m}{24}\right)}{\dfrac{m}{12}+\dfrac{V}{22,4}-\dfrac{m}{24}}=1,25.32=40\)
\(\Leftrightarrow15V-28m=0\left(1\right)\)
Ta lại có: \(n_{CaCO_3}=\dfrac{6}{100}=0,06\left(mol\right)\)
\(\Rightarrow\dfrac{m}{12}=0,06\Leftrightarrow m=0,72\left(2\right)\)
Từ (1) và (2) ta có hệ: \(\left\{{}\begin{matrix}15V-28m=0\\m=0,72\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}m=0,72\left(g\right)\\V=1,344\left(l\right)\end{matrix}\right.\)

Đáp án D
Ta có mMuối = mKim loại + mSO42–.
Mà nSO42– = nH2 = 0,05 mol.
⇒ mMuối = 2,43 + 0,05×96 = 7,23 gam
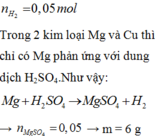
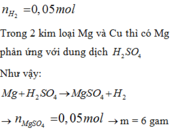
Dễ mà bạn
TL:
2Al + 3H2SO4 \(\rightarrow\) Al2(SO4)3 + 3H2 (1)
0,2 0,3 mol 0,1 mol 0,3 mol
Al2O3 + 3H2SO4 \(\rightarrow\) Al2(SO4)3 + 3H2O (2)
0,2 mol 0,6 mol 0,2 mol
Số mol của Al = 2/3 lần số mol của H2 (0,3 mol) = 0,2 mol. Do đó, số mol của Al2O3 = (25,8 - 27.0,2)/102 = 0,2 mol.
a) Sau phản ứng, số mol của Al2(SO4)3 thu được là 0,3 mol, do đó khối lượng = 102,6 gam.
b) Số mol H2SO4 = 0,9 mol, do đó khối lượng dd = 98.0,9.100/19,6 = 450 gam.
c) Khối lượng dd sau phản ứng = 450 + 25,8 - 2.0,3 = 475,2 gam.
Do đó: C% (Al2(SO4)3) = 102,6/475,2 = 21,59%.