Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Fe}=\dfrac{56}{56}=1mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
1 1 1 1
\(V_{H_2}=1\cdot22,4=22,4l\)

Fe+H2SO4->FeSO4+H2
0,25--0,25-----0,25---0,25
CuO+H2-to>Cu+H2O
0,25----0,25
n Fe=0,25 mol
m H2SO4=0,25.98=24,5g
m H2=0,25.22,4=5,6l
m Cu=0,25.64=16g

\(n_{Zn}=\dfrac{19.5}{65}=0.3\left(mol\right)\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(0.3........................0.3..........0.3\)
\(m_{ZnSO_4}=0.3\cdot161=48.3\left(g\right)\)
\(V_{H_2}=0.3\cdot22.4=6.72\left(l\right)\)
\(n_{CuO}=\dfrac{16}{80}=0.2\left(mol\right)\)
\(CuO+H_2\underrightarrow{^{^{t^0}}}Cu+H_2O\)
\(0.2..........0.3\)
\(LTL:\dfrac{0.2}{1}< \dfrac{0.3}{1}\Rightarrow H_2dư\)
\(m_{H_2\left(dư\right)}=\left(0.3-0.2\right)\cdot2=0.2\left(g\right)\)
a) $Zn + H_2SO_4 → ZnSO_4 + H_2$
b) n ZnSO4 = n Zn = 19,5/65 = 0,3(mol)
=> m ZnSO4 = 0,3.161 = 48,3(gam)
c) n H2 = n Zn = 0,3(mol)
V H2 = 0,3.22,4 = 6,72 lít
c)
$CuO + H_2 \xrightarrow{t^o} Cu + H_2O$
n CuO = 16/80 = 0,2(mol) < n H2 = 0,3 nên H2 dư
n H2 pư = n CuO = 0,2(mol)
=> m H2 dư = (0,3 - 0,2).2 = 0,2(gam)

a) Zn + 2HCl --> ZnCl2 + H2
b) \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
0,2------------------->0,2
=> VH2 = 0,2.22,4 = 4,48 (l)
c) \(n_{CuO}=\dfrac{24}{80}=0,3\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,2}{1}\) => CuO dư, H2 hết
PTHH: CuO + H2 --to--> Cu + H2O
0,2<--0,2
=> mCuO(Dư) = (0,3 - 0,2).80 = 8 (g)

a, \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Ta có: \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Zn}=0,2\left(mol\right)\Rightarrow V_{H_2}=0,2.22,4=4,48\left(l\right)\)
b, \(n_{CuO}=\dfrac{12}{80}=0,15\left(mol\right)\)
PT: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Xét tỉ lệ: \(\dfrac{0,15}{1}< \dfrac{0,2}{1}\), ta được H2 dư.
Theo PT: \(n_{H_2\left(pư\right)}=n_{CuO}=0,15\left(mol\right)\Rightarrow n_{H_2\left(dư\right)}=0,2-0,15=0,05\left(mol\right)\)

a.\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
0,2 0,3 ( mol )
\(V_{H_2}=0,3.22,4=6,72\left(l\right)\)
b.\(n_{CuO}=\dfrac{48}{80}=0,6\left(mol\right)\)
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\)
0,6 > 0,3 ( mol )
0,3 0,3 ( mol )
\(m_{Cu}=0,3.64=19,2\left(g\right)\)
c.\(2H_2+O_2\rightarrow\left(t^o\right)2H_2O\)
0,3 0,15 ( mol )
\(V_{kk}=V_{O_2}.5=\left(0,15.22,4\right).5=16,8\left(l\right)\)

1.\(n_{Zn}=\dfrac{13}{65}=0,2mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,2 0,2 ( mol )
\(V_{H_2}=0,2.22,4=4,48l\)
2.\(n_{CuO}=\dfrac{12}{80}=0,15mol\)
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\)
0,15 < 0,2 ( mol )
0,15 0,15 ( mol )
\(m_{Cu}=0,15.64=9,6g\)

a. Để tính khối lượng HCl đã dùng, ta cần biết số mol của Al đã phản ứng với HCl. Ta sử dụng phương trình phản ứng:
2Al + 6HCl → 2AlCl3 + 3H2
Theo đó, 2 mol Al tương ứng với 6 mol HCl. Vậy số mol HCl cần để phản ứng với 2,7 g Al là:
n(HCl) = n(Al) x (6/2) = 2,7/(27x2) x 6 = 0,05 mol
Khối lượng HCl tương ứng là:
m(HCl) = n(HCl) x M(HCl) = 0,05 x 36,5 = 1,825 g
Vậy khối lượng HCl đã dùng là 1,825 g.
b. Theo phương trình phản ứng, 2 mol Al tạo ra 3 mol H2. Vậy số mol H2 tạo ra từ 2,7 g Al là:
n(H2) = n(Al) x (3/2) = 2,7/(27x2) x 3 = 0,025 mol
Theo định luật Avogadro, 1 mol khí ở ĐKTC chiếm thể tích 22,4 L. Vậy thể tích H2 thu được là:
V(H2) = n(H2) x 22,4 = 0,025 x 22,4 = 0,56 L
P.c. CuO + H2 → Cu + H2O
Khối lượng CuO cần để khử hết 0,025 mol H2 là:
n(CuO) = n(H2)/2 = 0,0125 mol
m(CuO) = n(CuO) x M(CuO) = 0,0125 x 79,5 = 0,994 g
Vậy để khử hết H2, ta cần dùng 0,994 g CuO. Nếu dùng toàn bộ lượng H2 bay ra, chất CuO sẽ bị khử hoàn toàn thành Cu và không còn chất nào còn dư.

`1) PTHH:`
`Zn + 2HCl -> ZnCl_2 + H_2`
`0,2` `0,2` `(mol)`
`n_[Zn] = 13 / 65 = 0,2 (mol)`
`2) V_[H_2] = 0,2 . 22,4 = 4,48 (l)`
`3)`
`H_2 + CuO` $\xrightarrow[]{t^o}$ `Cu + H_2 O`
`0,15` `0,15` `(mol)`
`n_[CuO] = 12 / 80 = 0,15 (mol)`
Ta có: `[ 0,2 ] / 1 > [ 0,15 ] / 1`
`=>H_2` dư, `CuO` hết
`=> m_[H_2(dư)] = ( 0,2 - 0,15 ) . 2 = 0,1 (g)`
a, PT: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
b, Ta có: \(n_{Fe}=\dfrac{19,6}{56}=0,35\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Fe}=0,35\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,35.22,4=7,84\left(l\right)\)
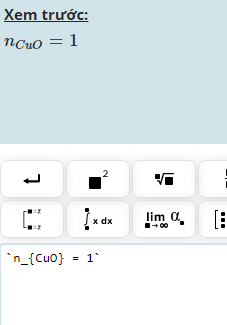
c, Ta có: \(n_{CuO}=\dfrac{12}{80}=0,15\left(mol\right)\)
PT: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Xét tỉ lệ: \(\dfrac{0,15}{1}< \dfrac{0,35}{1}\), ta được H2 dư.
Theo PT: \(n_{H_2\left(pư\right)}=n_{CuO}=0,15\left(mol\right)\)
\(\Rightarrow n_{H_2\left(dư\right)}=0,35-0,15=0,2\left(mol\right)\)
\(\Rightarrow m_{H_2\left(dư\right)}=0,2.2=0,4\left(g\right)\)