

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Chọn đáp án C
Đặt nAgNO3 = x mol; nCu(NO3)2 = y mol ⇒ a = 170x + 188y và ∑nNO3– = x + 2y mol.
Cu dư + X → Y ||⇒ Y chứa Cu(NO3)2 ⇒ nCu(NO3)2 = 0,5x + y ⇒ b = 94x + 188y.
Fe dư + Y → Z ||⇒ Z chứa Fe(NO3)2 ⇒ nFe(NO3)2 = 0,5x + y ⇒ c = 90x + 180y.
2b = a + c ⇒ 2 × (94x + 188y) = (170x + 188y) + (90x + 180y)
⇒ 72x = 8y ⇒ y = 9x ⇒ %mCu(NO3)2 = 188 × 9x ÷ (170x + 188 × 9x) × 100% = 90,87%.

Gọi số mol Mg (x); Fe trong Y là y và Fe trong Z là z
Ta có:
24x + 56y + 56z = 9,2
2x + 3y + 2z = 0,57 ( Bảo toàn e)
40x + 80z = 8,4
⇒ x = 0,15 ; y = 0,07 ; z = 0,03
%Fe = (0,1.56.100)/9,2 = 60,87%
Đáp án D

Đáp án B
+ Dung dịch Z phản ứng với dung dịch AgNO3 dư thu được khí NO, chứng tỏ trong Z có Fe2+, H+ và không còn NO 3 -
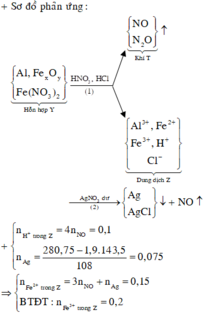


Nếu rắn Y không có Fe thì chỉ có Ag và Cu
Y phản ứng với dung dịch FeCl3 chỉ có Cu bị hòa tan
Khối lượng dung dịch tăng là khối lượng Cu 1,56 gam suy ra khối lượng ban đầu > 8,86 gam nên loại
Rắn Y gồm x mol AgNO3 , y mol Cu(NO3)2 và 0,04-(x/2 + y) mol Fe dư cho vào dung dịch FeCl3, chỉ có
Fe và Cu bị hòa tan làm cho khối lượng dung dịch tăng 1,56 gam
Có hệ phương trình: [0,04 - (x/2 + y)].56 + 64y = 1,56 gam
170x +188y = 8,86 gam hỗn hợp ban đầu
=> x = 0,03 mol AgNO3 tương ứng 57,56%
=> Đáp án A