Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 31:
Gọi CT chung của 2 kim loại nhóm IIA (kim loại X,Y) cần tìm là Z. (M(X)<M(Z)<M(Y))
Ta có: Z +2 HCl -> ZnCl2 + H2
nH2=0,672/22,4=0,03=nZ
=> 24<M(Z)=mZ/nZ= 1,67/0,03=35,667<40
=> M(Mg) < M(Z) < M(Ca)
=> X là Magie (Mg), Y là Canxi (Ca)
=> CHỌN B
Bài 33:
nH2=0,1(mol) => mH2=0,1.2=0,2(g)
Đặt CTHH chung của 2 kim loại kiềm là A.
PTHH: A + H2O -> AOH + 1/2 H2
nH2O=nH2.2=0,1.2=0,2(mol) => mH2O=3,6(g)
Theo ĐLBTKL ta có:
mA+ mH2O = mAOH + mH2
<=>mAOH=(mA+mH2O) - mH2= 6,2 + 3,6 - 0,2= 9,6(g)
=> m(rắn)=9,6(g)
=> CHỌN C

Coi hai nguyên tố là R \(\Rightarrow\overline{M}=M_R\)
a, PTHH:
\(2R+2H_2O\rightarrow2ROH+H_2\uparrow\)
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\Rightarrow n_R=2n_{H_2}=0,3\left(mol\right)\)
Khi đó \(\overline{M}=M_R=\dfrac{9,3}{0,3}=31\left(g/mol\right)\)
\(\Rightarrow\) Hai nguyên tố lần lượt là Na, K
b, PTHH:
\(2ROH+H_2SO_4\rightarrow R_2SO_4+2H_2O\)
\(\Rightarrow n_{H_2SO_4}=\dfrac{1}{2}n_{ROH}=n_{H_2}=0,15\left(mol\right)\)
\(\Rightarrow V_{ddH_2SO_4}=\dfrac{n_{H_2SO_4}}{C_M}=\dfrac{0,15}{2}=0,075\left(l\right)\)
\(n_{R_2SO_4}=n_{H_2SO_4}=0,15\left(mol\right)\)
\(\Rightarrow m_{R_2SO_4}=0,15.\left(31.2+32+16.4\right)=23,7\left(g\right)\)

Hoà tan hoàn toàn 6,2g hai kim loại kiềm ở 2 chu kì liên tiếp vào nước thu được H2 (đktc) và dung dịch X. Trung hòa ½ dung dịch X cần 100 ml dung dịch HCl 1M. Hai kim loại là
A. Li và Na B. Na và K C. K và Rb D. Rb và Cs
Gọi 2 kim loại cần tìm là R
\(R+H_2O\rightarrow ROH+\dfrac{1}{2}H_2\)
\(ROH+HCl\rightarrow RCl+H_2O\)
Số mol của 1/2 dung dịch X : \(n_{ROH}=n_{HCl}=0,1\left(mol\right)\)
\(n_{R\left(bđ\right)}=n_{ROH}=0,2\left(mol\right)\)
=> \(M_R=\dfrac{6,2}{0,2}=31\)
Vì hai kim loại kiềm ở 2 chu kì liên tiếp
=> 2 kim loại cần tìm là Na và K
=> Chọn B

a) Gọi công thức chung của 2 kim loại là R
PTHH: \(R+H_2O\rightarrow ROH+\dfrac{1}{2}H_2\uparrow\)
Ta có: \(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
\(\Rightarrow n_R=0,1\left(mol\right)\) \(\Rightarrow\overline{M}_R=\dfrac{3,26}{0,1}=32,6\)
Ta thấy \(23< 32,6< 39\) \(\Rightarrow\) 2 kim loại cần tìm là Natri và Kali
b) PTHH: \(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\uparrow\)
a_____________a______\(\dfrac{1}{2}\)a (mol)
\(K+H_2O\rightarrow KOH+\dfrac{1}{2}H_2\uparrow\)
b____________b______\(\dfrac{1}{2}\)b (mol)
Ta lập HPT: \(\left\{{}\begin{matrix}23a+39b=3,26\\\dfrac{1}{2}a+\dfrac{1}{2}b=0,05\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,04\\b=0,06\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Na}=\dfrac{0,04\cdot23}{3,26}\cdot100\%\approx28,22\%\\\%m_K=71,78\%\end{matrix}\right.\)
c) PT ion: \(OH^-+H^+\rightarrow H_2O\)
0,1____0,1
Ta có: \(n_{H^+}=n_{HCl}=0,1\left(mol\right)\) \(\Rightarrow m_{ddHCl}=\dfrac{0,1\cdot36,5}{5\%}=73\left(g\right)\)

a)$n_{H_2} = 0,2(mol)$
$n_{H_2O\ pư} = 2n_{H_2} = 0,2.2 = 0,4(mol)$
Bảo toàn khối lượng : $m = 4,4 + 0,4.18 - 0,2.2 = 11,2(gam)$
b)
$n_{OH(trong\ X)} = 2n_{H_2} = 0,4(mol)$
$OH^- + H^+ \to H_2O$
$n_{H^+} = n_{OH(trong\ \(\dfrac{1}{2}\)\ dd\ X)} = 0,4 : 2 = 0,2(mol)$
$n_{H_2SO_4} = \dfrac{1}{2}n_{H^+} = 0,1(mol)$
$V_{dd\ H_2SO_4} = \dfrac{0,1}{0,2} = 0,5M$
c)
$\overline{M_{kim\ loại}} = \dfrac{4,4}{0,4} = 11$
Vậy hai kim loại là Liti(a mol) và Natri(b mol)
Ta có :
$7a + 23b = 4,4$
$a + b = 0,4$
Suy ra a = 0,3 ; b = 0,1
$m_{dd\ X} = 4,4 + 100 - 0,2.2 = 104(gam)$
$C\%_{LiOH} = \dfrac{0,3.24}{104}.100\% = 6,92\%$
$C\%_{NaOH} = \dfrac{0,1.40}{104}.100\% = 3,84\%$

Giải chi tiết:
Gọi công thức chung của kim loại kiềm đó là X
X + HCl → XCl + 0,5H2
Theo PTHH: nX = 2nH2 = 0,2 mol
=> Li (M = 7) < MX = 3,8 : 0,2 = 19 < Na (M = 23)
Đáp án A

a) Gọi số mol Zn, Fe là a, b (mol)
=> 65a + 56b = 7,35 (1)
PTHH: Zn + 2HCl --> ZnCl2 + H2
a---->2a------->a------>a
Fe + 2HCl --> FeCl2 + H2
b------>2b----->b------>b
=> \(a+b=\dfrac{2,688}{22,4}=0,12\left(mol\right)\)
=> a + b = 0,12 (2)
(1)(2) => a = 0,07; b = 0,05
=> \(\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{0,07.65}{7,35}.100\%=61,9\%\\\%m_{Fe}=\dfrac{0,05.56}{7,35}.100\%=38,1\%\end{matrix}\right.\)
b) nHCl(dư) = 0,3.1 - 0,07.2 - 0,05.2 = 0,06 (mol)
PTHH: Ca(OH)2 + 2HCl --> CaCl2 + 2H2O
0,03<-----0,06
=> \(x=C_{M\left(ddCa\left(OH\right)_2\right)}=\dfrac{0,03}{0,1}=0,3M\)
c) Chất rắn thu được là Fe2O3
Bảo toàn Fe: \(n_{Fe_2O_3}=0,025\left(mol\right)\)
=> \(a=m_{Fe_2O_3}=0,025.160=4\left(g\right)\)
Kết tủa thu được là Fe(OH)2
Bảo toàn Fe: \(n_{Fe\left(OH\right)_2}=0,05\left(mol\right)\)
=> \(m=m_{Fe\left(OH\right)_2}=0,05.90=4,5\left(g\right)\)


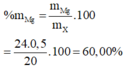

n H2 = \(\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Gọi chung hai kim loại là X ta có :
2X + 2H2O → 2XOH + H2↑ .
Theo PTHH ta có : n X = 2 nH2 =0,3(mol).
⇒ \(\overline{M_X}=\dfrac{8,5}{3}=28,33\)
Dựa vào BTH ta thấy : M Na = 23 < 28,33 < 39 = MK
Vậy hai kim loại là Na và K.
Gọi số mol của Na và K lần lượt là x và y ta có hệ phương trình:
\(\left\{{}\begin{matrix}x+y=0,3\\23x+39y=8,5\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
2NaOH + H2SO4 → Na2SO4 + 2H2O
0,2............0,1
2KOH + H2SO4 → K2SO4 + 2H2O
0,1..........0,05
\(\Rightarrow n_{H_2SO_4}=0,1+0,05=0,15\left(mol\right)\)
=> \(V_{H_2SO_4}=\dfrac{0,15}{1}=0,15\left(mol\right)\)