Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) \(n_{AlCl_3}=\dfrac{6,675}{133,5}=0,05\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
0,05<-----------0,05---->0,075
=> \(\%Al=\dfrac{0,05.27}{14,15}.100\%=9,54\%\)
=> \(\%Cu=\dfrac{14,15-0,05.27}{14,15}.100\%=90,46\%\)
b) \(V_{H_2}=0,075.22,4=1,68\left(l\right)\)
c) \(n_{Cu}=\dfrac{14,15-0,05.27}{64}=0,2\left(mol\right)\)
PTHH: 4Al + 3O2 --to--> 2Al2O3
0,05->0,0375
2Cu + O2 --to--> 2CuO
0,2-->0,1
=> \(V_{O_2}=\left(0,1+0,0375\right).22,4=3,08\left(l\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\\ m_{AlCl_3}=6,675\left(mol\right)\\ n_{AlCl_3}=\dfrac{6,675}{133,5}=0,05\left(mol\right)\\ \Rightarrow n_{Al}=n_{AlCl_3}=0,05\left(mol\right)\\ \Rightarrow m_A=0,05.27=1,35\left(g\right);m_{Cu}=14,15-1,35=12,8\left(g\right)\\ \%m_{Cu}=\dfrac{12,8}{14,15}.100\approx90,459\%\\ \Rightarrow\%m_{Al}\approx9,541\%\\ b,n_{Cu}=\dfrac{12,8}{64}=0,2\left(mol\right)\\ n_{H_2}=\dfrac{3}{2}.n_{Al}=\dfrac{3}{2}.0,05=0,075\left(mol\right)\\ \Rightarrow V=V_{H_2\left(đktc\right)}=0,075.22,4=1,68\left(l\right)\\ 4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\\ 2Cu+O_2\rightarrow\left(t^o\right)2CuO\\ n_{O_2}=\dfrac{3}{4}.n_{Al}+\dfrac{1}{2}.n_{Cu}=\dfrac{3}{4}.0,05+\dfrac{1}{2}.0,2=0,0875\left(mol\right)\)
\(\Rightarrow V_{O_2\left(đktc\right)}=0,0875.22,4=1,96\left(l\right)\)

a) PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\) (1)
\(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\) (2)
b) Dựa vào đề, ta thấy chắc chắn HCl dư
Ta có: \(\Sigma n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Gọi số mol của Fe là \(a\) \(\Rightarrow n_{H_2\left(1\right)}=a\)
Gọi số mol của Mg là \(b\) \(\Rightarrow n_{H_2\left(2\right)}=b\)
Ta lập được hệ phương trình:
\(\left\{{}\begin{matrix}56a+24b=8\\a+b=0,2\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Fe}=56\cdot0,1=5,6\left(g\right)\\m_{Mg}=24\cdot0,1=2,4\left(g\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{5,6}{8}\cdot100\%=70\%\\\%m_{Mg}=30\%\end{matrix}\right.\)
c) Theo các PTHH: \(n_{FeCl_2}=n_{MgCl_2}=n_{Fe}=n_{Mg}=0,1mol\)
\(\Rightarrow\left\{{}\begin{matrix}m_{FeCl_2}=0,1\cdot127=12,7\left(g\right)\\m_{MgCl_2}=0,1\cdot95=9,5\left(g\right)\end{matrix}\right.\) \(\Rightarrow m_{muối}=22,2\left(g\right)\)
d) Ta có: \(\Sigma n_{HCl}=\dfrac{500\cdot16\%}{36,5}=\dfrac{160}{73}\left(mol\right)\)
\(\Rightarrow n_{HCl\left(dư\right)}=\dfrac{654}{365}\left(mol\right)\) \(\Rightarrow m_{HCl\left(dư\right)}=\dfrac{654}{365}\cdot36,5=65,4\left(g\right)\)
Mặt khác: \(m_{dd}=m_{hh}+m_{ddHCl}-m_{H_2}=507,6\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{FeCl_2}=\dfrac{12,7}{507,6}\cdot100\%\approx2,5\%\\C\%_{MgCl_2}=\dfrac{9,5}{507,6}\cdot100\%\approx1,87\%\\C\%_{HCl\left(dư\right)}=\dfrac{65,4}{507,6}\cdot100\%\approx12,88\%\end{matrix}\right.\)

Đề chưa nói rõ là : tác dụng với dung dịch axit nào nên có lẽ là HCl hoặc H2SO4 , thứ hai là câu c không đủ dữ kiện đề bài để giải nhé.
\(Đặt:n_{Mg}=x\left(mol\right),n_{Fe}=y\left(mol\right)\)
\(m_{hh}=24x+56y=8\left(g\right)\left(1\right)\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\\ Fe+2HCl\rightarrow FeCl_2+H_2\)
\(n_{H_2}=x+y=0.2\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):x=y=0.1\)
\(\%Mg=\dfrac{0.1\cdot24}{8}\cdot100\%=30\%\\ \%Fe=70\%\)
\(m_M=m_{MgCl_2}+m_{FeCl_2}=0.1\cdot95+0.1\cdot127=22.2\left(g\right)\)

mình cần giải gấp khoảng 1 tiếng ai có thể giải giùm mình được ko

Câu 1:
Gọi số mol Al là x; Zn là y
\(\rightarrow27x+65y=18,4\)
\(Al+3HCl\rightarrow AlCl_3+\frac{3}{2}H_2\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(\rightarrow n_{H2}=1,5n_{Al}+n_{Zn}=1,5x+y=\frac{1}{2}=0,5\left(mol\right)\)
Giải được: \(x=y=0,2\)
\(\Rightarrow m_{Al}=27x=5,4\left(g\right)\Rightarrow\%m_{Al}=\frac{5,4}{18,4}=29,3\%\Rightarrow\%m_{Zn}=70,7\%\)Câu 2:
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(FeO+2HCl\rightarrow FeCl_2+H_2\)
Ta có: \(n_{H2}=n_{Fe}=\frac{2,24}{22,4}=0,1\left(mol\right)\)
Muối thu được là FeCl2
\(\rightarrow n_{FeCl2}=\frac{38,1}{56+35,5.2}=0,3\left(mol\right)\)
Ta có: \(n_{FeCl2}=n_{Fe}+n_{FeO}\rightarrow n_{FeO}=0,2\left(mol\right)\)
\(\Rightarrow m_{Fe}=0,1.56=5,6\left(g\right);m_{FeO}=0,2.\left(56+16\right)=14,4\left(g\right)\)
Câu 3 :
Cu không tác dụng với HCl, chỉ có Zn phản ứng.
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Ta có: \(n_{H2}=\frac{4,48}{22,4}=0,2\left(mol\right)\)
Theo phản ứng: \(n_{Zn}=n_{H2}=0,2\left(mol\right)\rightarrow m_{Zn}=0,2.65=13\left(g\right)\)
\(\rightarrow\%m_{Zn}=\frac{13}{20}=65\%\rightarrow\%m_{Cu}=35\%\)
Ta có: \(n_{HCl}=2n_{H2}=0,2.2=0,4\left(mol\right)\)
\(\Rightarrow V_{HCl}=\frac{0,4}{2}=0,2\left(l\right)\)
Câu 4:
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(Al+3HCl\rightarrow AlCl_3+\frac{3}{2}H_2\)
Gọi số mol Fe là x; Al là y
\(\rightarrow56x+27y=22\)
Ta có: \(n_{H2}=n_{Fe}=1,5n_{Al}=x+1,5y=\frac{17,92}{22,4}=0,8\left(mol\right)\)
Giải được: \(\rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,4\end{matrix}\right.\)
\(\Rightarrow m_{Fe}=0,2.56=11,2\left(g\right)\)
\(\rightarrow\%m_{Fe}=\frac{11,2}{22}=50,9\%\rightarrow\%m_{Al}=49,1\%\)
Ta có: \(n_{HCl}=2n_{H2}=1,6\left(mol\right)\)
\(\rightarrow m_{HCl}=1,6.36,5=58,4\left(g\right)\)
\(\rightarrow m_{dd_{HCl}}=\frac{58,4}{7,3\%}=800\left(g\right)\)
Câu 5:
Gọi chung 2 kim loại là R hóa trị I
\(R+HCl\rightarrow RCl+\frac{1}{2}H_2\)
Ta có: \(n_{H2}=\frac{0,448}{22,4}=0,02\left(mol\right)\rightarrow n_{RCl}=2n_{H2}=0,04\left(mol\right)\)
\(\rightarrow m_{RCl}=0,04.\left(R+35,5\right)=2,58\rightarrow R=29\)
Vì 2 kim loại liên tiếp nhau \(\rightarrow\) 2 kim loại là Na x mol và K y mol
\(\rightarrow x+y=n_{RCl}=0,04\left(mol\right)\)
\(m_{hh}=m_R=23x+39y=0,04.29=1,16\left(g\right)\)
Giải được: \(\rightarrow\left\{{}\begin{matrix}x=0,025\\y=0,015\end{matrix}\right.\)
\(\rightarrow m_{Na}=0,575\left(g\right)\)
\(\rightarrow\%m_{Na}=\frac{0,575}{1,16}=49,57\%\rightarrow\%m_K=50,43\%\)
Câu 6:
Khối lượng mỗi phần là 35/2=17,5g
Gọi số mol Fe, Cu, Al là a, b, c
Ta có \(56a+64b=27c=17,5\)
Phần 1: \(n_{H2}=\frac{6,72}{22,4}=0,3\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(\Rightarrow a=1,5b=n_{H2}=0,3\)
Phần 2: \(n_{Cl2}=\frac{10,64}{22,4}=0,475\left(mol\right)\)
\(2Fe+3Cl_2\rightarrow2FeCl_3\)
\(Cu+Cl_2\rightarrow CuCl_2\)
\(2Al+3Cl_2\rightarrow2AlCl_3\)
\(\Rightarrow1,5a+b+1,5c=n_{Cl2}=0,465\)
\(\rightarrow\left\{{}\begin{matrix}a=0,15\\b=0,1\\c=0,1\end{matrix}\right.\)
\(\rightarrow\%m_{Fe}=\frac{0,15.56}{17,5}=48\%\)
\(\rightarrow\%m_{Cu}=\frac{0,1.64}{17,5}=36,57\%\)
\(\rightarrow\%m_{Al}=100\%-48\%-36,57\%=15,43\%\)
Câu 1
2Al+6HCl--->2Alcl3+3H2
x-----------------------1,5x
Zn+2HCl---->Zncl2+H2
y---------------------------y
n H2=1/2=0,5(mol)
Theo bài ta có hpt
\(\left\{{}\begin{matrix}27x+65y=18,4\\1,5x+y=0,5\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,2\end{matrix}\right.\)
%m Al=0,2.27/18,4.100%=29,35%
%m Zn=100%-29,35=70,65%
Câu 2.
Fe+2HCl---->FeCl2+H2
FeO+2HCl--->FeCl2+H2
n H2=2,24/22,4=0,1(mol)
m H2=0,2(g)
n Fe=n H2=0,2(mol)
m Fe=0,2.56=11,2(g)
n FeCl2(1)=2n H2=0,2(mol)
m FeCl2(1)=0,2.127=25,4(g)
m FeCl2(PT2)=38,1-25,4=12,7(g)
n FeCl2=12,7/127=0,1(mol)
n FeO=n FeCl2=0,1(mol)
m FeO=0,1.72=7,2(g)
3.
Zn+2HCl--->ZnCl2+H2
n H2=4,48/22,4=0,2(mol)
n Zn=n H2=0,2(mol)
m Zn=0,2.56=11,2(g)
%m Zn=11,2/20.100%=56%
%m Cu=100-56=34%
b) n HCl=2n H2=0,4(mol)
V H2=0,4/2=0,2(l)
4.
a) Fe+2HCl---.FeCl2+H2
x-----------------------------x(mol)
2Al+6HCl--->AlCl3+3H2
y------------------------------1,5y
n H2=17,92/22,4=0,89mol)
Theo bài ta có hpt
\(\left\{{}\begin{matrix}56x+27y=22\\x+1,5y=0,8\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,4\end{matrix}\right.\)
%m Fe=0,2.56/22.100%=50,9%
%m Al=100-50,9=49,1%
b) n HCl=2n H2=1,6(mol)
m HCl=1,6.36,5=58,4(g)
m dd HCl=58,4.100/7,3=800(g)

\(a)n_{Mg} = a ; n_{Al} = b \Rightarrow 24a +27b = 5,1(1)\\ Mg + 2HCl \to MgCl_2 + H_2\\ 2Al + 6HCl \to 2AlCl_3 + 3H_2\\ n_{H_2} = a + 1,5b = \dfrac{5,6}{22,4} = 0,25(2)\\ (1)(2) \Rightarrow a = 0,1 ; b = 0,1\\ \%m_{Mg} = \dfrac{0,1.24}{5,1}.100\% = 44,44\%\ ;\ \%m_{Al} = 100\% -44,44\% = 55,56\%\\ b) n_{MgCl_2} = n_{Mg} = 0,1 \Rightarrow m_{MgCl_2} = 0,1.95 = 9,5(gam)\\ n_{AlCl_3} = n_{Al} = 0,1 \Rightarrow m_{AlCl_3} = 0,1.133,5 = 13,35(gam)\\ c)n_{HCl} = 2n_{Mg} + 3n_{Al} = 0,5(mol) \Rightarrow m_{dd\ HCl} = \dfrac{0,5.36,5}{3,65\%} = 500(gam)\)
\(m_{dd\ sau\ pư} = 5,1 + 500 - 0,25.2 = 504,6(gam)\\ C\%_{MgCl_2} = \dfrac{9,5}{504,6}.100\% = 1,89\%\\ C\%_{AlCl_3} = \dfrac{13,35}{504,6}.100\% = 2,65\%\)

NaBr xmol NaI ymol+Br2
2NaI+Br2=>2NaBr +I2
=>y=m/(127-80)=m/47 mol
NaBr (x+y )mol +Cl2=>NaCl+Cl2
=>x+y=m/(80-35.5)=m/44.5=>x=5m/4183
=>mNaBr=515m/4183 mNaI=150m/47 =>%NaBr=3.71%
NaBr xmol NaI ymol+Br2
2NaI+Br2=>2NaBr +I2
=>y=m/(127-80)=m/47 mol
NaBr (x+y )mol +Cl2=>NaCl+Cl2
=>x+y=m/(80-35.5)=m/44.5=>x=5m/4183
=>mNaBr=515m/4183 mNaI=150m/47 =>%NaBr=3.71%


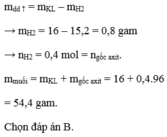
Khối lượng dung dịch tăng = m hỗn hợp kim loại - m khí H2 thoát ra
\(\Rightarrow\Delta m=m_{hh\left(kl\right)}-m_{H2}\)
\(\Rightarrow10,2=m_{hh\left(kl\right)}-m_{H2}\rightarrow m_{hh\left(kl\right)}=10,2+m_{H2}\)
Bảo toàn mol H \(\Rightarrow n_{HCl}=2n_{H2}\)
Áp dụng BTKL:
\(m_{hh\left(kl\right)}+36,5.n_{HCl}=39,4+2.n_{H2}\)
\(\Rightarrow10,2+m_{H2}+36,5.2.n_{H2}=39,4+2.n_{H2}\)
\(\Rightarrow10,2+2.n_{H2}+36,5.2.n_{H2}=39,4+2.n_{H2}\)
\(\Rightarrow n_{H2}=0,4\left(mol\right)\)
\(\Rightarrow m_{H2}=0,4.2=0,8\left(mol\right)\)
\(m_{hh\left(kl\right)}=10,2+0,8=11\left(g\right)\)
Gọi số mol Al, Fe lần lượt là x;y
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Ta có HPT:
\(\left\{{}\begin{matrix}27x+56y=11\\1,5x+y=0,4\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,2\left(mol\right)\\y=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{Al}=0,2.27=5,4\left(g\right)\)
\(\Rightarrow\%m_{Al}=\frac{5,4}{11}.100\%=49,1\%\)
\(\Rightarrow\%m_{Fe}=100\%-49,1\%=50,9\%\)