Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
nS = nBaSO4= 0,024 => mFe + mCu = 2,496 (1)
nNO = 0,084; nHNO3 = 0,6
Bảo toàn N => nNO3 sau = nHNO3 – nNO = 0,516
Bảo toàn O => 3nHNO3 = nNO + 3nNO3 sau + 4nSO4 + nH2O => nH2O = 0,072
Bảo toàn H => nHNO3 = 2nH2O + nH+dư =>nH+dư = 0,456 => Chỉ tạo Fe3+
Bảo toàn ne => 3nFe + 2nCu + 6nS = 3nNO (2)
(1), (2) => nFe = 0,024; nCu = 0,018
3Fe + 8H+ + 2NO3- → 3Fe2+ + 2NO + 4H2O
Fe + Cu2+ → Fe2+ + Cu
Fe + 2Fe3+ → 3Fe2+
=> nFe = 0,375nH+dư + nCu2+ + 0,5nFe3+ = 0,201 => m = 11,256 => Chọn D.

Chọn A
Quy đổi hỗn hợp về Fe (x mol); Cu (y mol) và S (z mol)
Bảo toàn S có
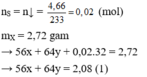
Do Y có thể hòa tan được Cu, bảo toàn electron có:
3 . n F e + 2 . n C u + 6 . n S = 3 . 0 , 07
→ 3x + 2y = 0,09 (2)
Từ (1) và (2) có: x = 0,02 và y = 0,015.
Dung dịch Y gồm: F e 3 + : 0,02 mol; C u 2 + : 0,015 mol; S O 4 2 - = 0,02 mol; N O 3 - = (0,5 – 0,07 = 0,43 mol) và có thể có H +
Bảo toàn điện tích → n H + = 0,38 mol
Cho Cu vào Y có phản ứng:
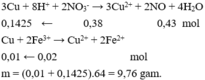

Đáp án D
Trước hết, cần nắm được quá trình các phản ứng xảy ra, sau đó biểu diễn sơ đồ:
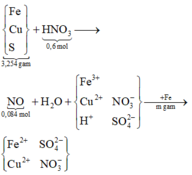
• BaCl2 kết tủa hết gốc sunfat trong Y thu được 0,024 mol BaSO4.
Quy đổi hỗn hợp X về x mol Fe, y mol Cu và 0,024 mol S

Giải hệ được x = 0,024 mol; y = 0,018 mol. Vì Fe hòa tan tối đa nên cuối cùng sẽ chỉ thu được Fe2+ thôi.
Thường các bạn học tốt có thể dùng luôn bảo toàn electron để tính nhanh ra kết quả. Nếu không, các bạn cũng có thể nhìn ra được hướng giải tiếp theo (hướng chắc chắn và cũng khá dễ dàng) bằng cách gộp cả quá trình bằng sơ đồ sau:

Như đã từng nói, quan trọng nhất là nắm được quá trình các phản ứng xảy ra, viết được sơ đồ, việc còn lại sẽ rất đơn giản; hãy tự tin rằng: “cho tôi sơ đồ quá trình, tôi có thể giải được mọi bài tập hóa!”.
Thật vậy, bảo toàn nguyên tố H có 0,3 mol H2O. Ghép cụm NO3: 1NO + 2O(*) → 1NO3
Lượng O ở (*) lấy từ 0,3 mol O trong H2O cùng 0,024 × 4 mol O trong gốc SO4


Đáp án A
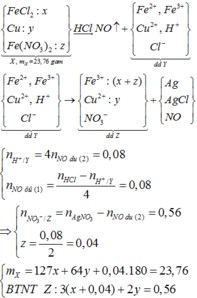
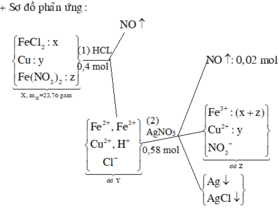
Ta có sơ đồ : 23,76g X + 0,4 mol HCl -> NO + dd Y → 0,02 mol NO + Kết tủa + dd Z
Trong Z có Fe(NO3)3 , Cu(NO3)2
nH+ = 0,4 mol => nNO = ¼ nH+ = 0,1 mol
Trong TN1 : nNO = 0,1 – 0,02 = 0,08 mol
=> Trong X có 0,04 mol Fe(NO3)2 => Trong Z
nNO3 = 0,58 – 0,02 = 0,56 mol
Gọi số mol FeCl2 và Cu trong X lần lượt là a và b
=> 127a + 64b = 16,56g (1)
nNO3 (Z) = (a + 0,04).3 + 2b = 0,56 (2)
Từ (1,2) => a = 0,08 ; b = 0,1 mol
Kết tủa thu được gồm :
nAgCl = nCl- = 0,4 + 2.0,08 = 0,56 mol
nAg = 0,08 + 0,1.2 + 0,04 – 0,1.3 = 0,02 mol
=> mkết tủa = 82,52g




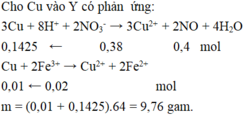
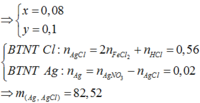

Đáp án A
n H N O 3 = 0,864 mol; nNO = 0,186 mol
n H N O 3 > n N O => Trong dd Y có chứa N O 3 - : n N O 3 - = 0,864 – 0,186 = 0,678 mol
Khi cho B a C l 2 dư tác dụng với Y: m kết tủa = m B a S O 4 = 11,184 gam
=> n S O 4 2 - = m B a S O 4 = 11,184:233 = 0,048 mol
BTNT “O”: 3 n H N O 3 = 4 n S O 4 2 - + 3 n N O 3 - + n N O + n H 2 O
=> 3.0,864 = 0,048.4 + 0,678.3 + 0,186 + n H 2 O = > n H 2 O = 0,18 mol
BTNT “H”: n H N O 3 = n H + ( Y ) + 2 n H 2 O = > 0 , 864 = n H + ( Y ) + 0 , 18 . 2 = > n H + ( Y ) = 0,504 mol
Như vậy ta có sơ đồ sau:
+ H N O 3 : 0 , 864 → Y + N O : 0 , 186 + H 2 O : 0 , 18
56x + 64y = 8,976 – 0,048.32 (1)
BTĐT dd Y: 3x + 2y + 0,504 = 0,048.2 + 0,678 (2)
Giải (1) và (2) được x = 0,03 và y = 0,09
Cho Y tác dụng với tối đa Fe:
3 F e + 8 H + + 2 N O 3 - → 3 F e 2 + + 2 N O + 4 H 2 O
0,189 ← 0,504
F e + 2 F e 3 + → 3 F e 2 +
0,015 ← 0,03
F e + C u 2 + → F e 2 + + C u
0,09 ← 0,09
=> m = (0,189 + 0,015 + 0,09).56 = 16,464 gam