

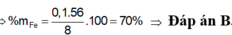
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


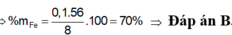

Đáp án A
n H 2 = 0 , 2 ( m o l )
=> mhh= mFe + mAl
Bảo toàn electron:
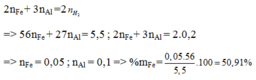

Đáp án D.
Gọi nCu = y, nFe = x mol

Áp dụng định luật bảo toàn e ta có: 3x+2y = 0,7 (1)
Khối lượng hai kim loại = 1,84 g: 56x+64y = 184 (2).
Giải 1,2 ta có: x = 0,1, y = 0,2 (mol)
% m F e = 0 , 1 . 56 18 , 4 . 100 % = 30 , 43 %

\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
0,2<-----------------------0,2
=> \(n_{Ag}=\dfrac{22-0,2.56}{108}=0,1\left(mol\right)\)
=> \(\%n_{Ag}=\dfrac{0,1}{0,1+0,2}.100\%=33,33\%\)

Đáp án C
Trong X, chỉ có Fe tác dụng với dung dịch H2SO4 loãng:


+ HCl và Cl2 đều đóng vai trò chất oxi hóa, mấu chốt của bài toán ta cần nhận ra được: Zn, Mg có hóa trị không đổi; Fe có nhiều hóa trị, cụ thể khi tác dụng với dung dịch thu được muối sắt (II), còn khi tác dụng với Cl2 thu được muối sắt (III).
+ Sử dụng công thức tính nhanh số mol Fe trong X:
![]()
![]()
![]()
Đáp án D