Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nH+ = 4nNO + 2nO
—> nO = 0,08 nO(X) = 0,5
—> nNO3-(X) = (0,5 – 0,08)/3 = 0,14
—> nFe = (mX – mO – mNO3-)/56 = 0,26
Dung dịch Y chứa Fe2+ (x), Fe3+ (y), Na+ (a) và NO3-
Bảo toàn N —> nNO3- = 0,14 + a + 0,64 – 0,12 = a + 0,66
Bảo toàn điện tích cho Y
—> 2x + 3y + a = a + 0,66
nFe = x + y = 0,26 —> x = 0,12; y = 0,14
nNaOH = 0,72 > 2x + 3y = 0,66 —> NaOH dư
nNaOH dư = 0,72 – 0,66 = 0,06
—> Chất rắn sau khi nung gồm NaOH dư (0,06) và NaNO2 (0,66 + a)
—> m rắn = 40.0,06 + 69(a + 0,66) = 57,6 —> a = 0,14
#TK

Đáp án D
n H 2 = 0 , 5 mol
Cu là kim loại đứng sau hidro trong dãy hoạt động hoá học, do đó Cu không tác dụng với dung dịch HCl
Sơ đồ phản ứng:
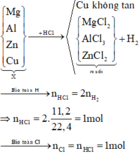
Khối lượng muối chính là khối lượng kim loại Mg, Al, Zn và Cl. Khi đó ta có:
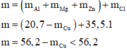
Chỉ có 49,80 < 56,2. Vậy giá trị của m có thể là 49,80 gam

Ta có: \(m_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\) \(\Rightarrow m_{H_2}=0,2\cdot2=0,4\left(g\right)\)
\(\Rightarrow m_{dd\left(sau.pư\right)}=m_{hh}+m_{ddH_2SO_4}-m_{H_2}=309,6\left(g\right)\)
\(\Rightarrow a=309,6-300=9,6\left(g\right)\)


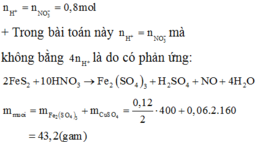


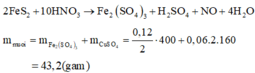


Do chứa muối trung hòa nên dung dịch Y chứa Al3+ a mol, Zn2+ b mol, NH4+ c mol và SO42- 0,585 mol.
Bảo toàn điện tích: 3a + 2b + c = 0,585.2
mmuốimmuối = 27a + 65b + 18c + 96.0,585 = 79,65
nNaOHnNaOH = 4a + 4b + c = 1,91
=> a = 0,2; b = 0,27; c = 0,03
Hỗn hợp khí Z chứa CO2 x mol, N2 y mol và H2 z mol
→nZ→nZ = x + y + z = 0,18
nH+nH+ = 2x + 12y + 2z + 0,03.10 = 0,585.2 + 0,09
Bảo toàn nguyên tố N: nNO−3(X)nNO-3(X) = 2y + 0,03 - 0,09 = 2y - 0,06
Trong X:
=>62(2y - 0,06) + 60x = 8,52
=> x = 0,08; y = 0,06; z = 0,04 →nZn→nZn = b - x = 0,19
=> %Zn = 39,24%
=>ý A