Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
n(Fe) = 0,02 mol; n(Cu) = 0,015 mol; n(Mg) = 0,05
Mg tạo NO = 0,015 → còn lại 0,035 mol phản ứng với kim loại
Sau phản ứng có: 0,01 mol Fe; 0,015 mol Cu → m = 1,52 gam

Đáp án A
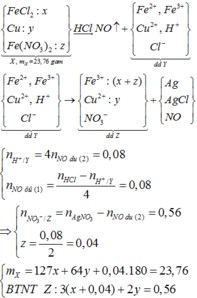
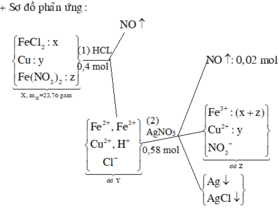
Từ phản ứng: 3e + 4H+ + NO3- → NO + 2H2O
=> X chứa Fe2+ (0,05 mol), Cu2+, H+, Cl- (0,2 mol).
Khi co X tác dụng với AgNO3 thu được kết tủa là AgCl (0,2 mol) và Ag (0,05 mol) => m ↓ = 34,1 (g)

Đáp án D
Tổng số mol NO là 0,05 + 0,02 = 0,07
Giả sử trong Y có cả Fe3+ và Fe2+.
Bảo toàn ne=> 3nFe3+ + 2nFe2+ = 3nNO = 0,21
Mặt khác: Cu + 2Fe3+ → 2Fe2+ + Cu2+
=> nFe3+ = 2nCu = 2.0,0325 = 0,065 => nFe2+ = 0,0075
=> mFe = 56(0,065 + 0,0075) = 4,06g => Chọn D.
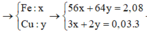



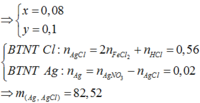

Đáp án B
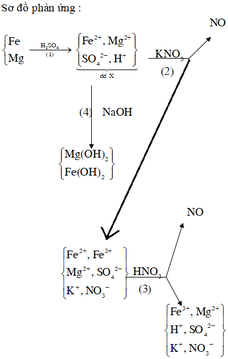
Vì khi cho Mg vào dung dịch X thì vẫn thu được khí NO nên trong dung dịch X có HNO3 dư.
Khi trong dung dịch X có HNO3 dư thì cả Fe và Cu đều tan hết và được đưa lên mức số oxi hóa tối đa, lần lượt là +3 và +2.
Khi thêm Mg vào dung dịch X: nMg = 0,05; nNO =0,01.
Các phương trình phản ứng xảy ra:
Do đó chất rắn thu được sau phản ứng gồm 0,015 mol Cu và 0,01 mol Fe.
Vậy m = mFe + mCu = 1,52 (gam)